Wirkstoffforschung im Hochdurchsatz
Forschungsbericht (importiert) 2016 - Max-Planck-Institut für molekulare Physiologie
Kleine Moleküle als Modulatoren biologischer Aktivität
Biologische Prozesse werden von den Wechselwirkungen innerhalb eines räumlich und zeitlich gesteuerten Netzwerks von Funktionsträgern, hauptsächlich Proteinen, bestimmt. Niedermolekulare Substanzen sind in der Lage, biologische Prozesse zu beeinflussen, indem sie mit den Proteinen direkt interagieren. Diese auch als „kleine Moleküle“ bezeichneten chemischen Stoffe können beispielsweise Wechselwirkungen zwischen Proteinen unterbinden oder enzymatische Aktivitäten hemmen. Trotz des beträchtlichen Größenunterschieds kann der Einfluss der kleinen Moleküle sehr potent sein, indem sie, wie das sprichwörtliche Körnchen Sand im Getriebe, Schlüsselpositionen in den Zielproteinen besetzen. Ihre Wirkung ist dabei immer akut und gut dosierbar und meist reversibel.
Viele täglich eingesetzte Arzneimittel stammen aus der Gruppe der niedermolekularen Substanzen. Historisch wurden die meisten Arzneistoffe auf der Grundlage von Naturstoffen mit bekannter Wirkung entwickelt oder per Zufallsprinzip entdeckt [1]. Mit der Entwicklung von molekulargenetischen Methoden und spätestens mit der Entschlüsselung des humanen Genoms kam es in der Wirkstoffforschung zu einem Paradigmenwechsel [2]. Durch die Identifizierung von Krankheitsursachen auf molekularer Ebene konnte nun gezielt nach Modulatoren bestimmter zellulärer Funktionsträger gesucht werden.
Transfer von wissenschaftlichen Erkenntnissen in die medizinische Forschung
Die Aufklärung zellulärer Funktionsmechanismen auf molekularer Ebene eröffnet immer auch die Chance, regulierend in krankheitsrelevante Prozesse einzugreifen. Das COMAS ermöglicht es Max-Planck-Forschungsgruppen, mit Hilfe von Hochdurchsatz-Suchen (Screening) in einer Bibliothek aus zehntausenden niedermolekularen Verbindungen potentielle Modulatoren zellulärer Funktionen zu identifizieren. Das Ziel des COMAS ist es, wissenschaftliche Erkenntnisse aus der Grundlagenforschung für die medizinische Forschung und die Entwicklung neuer therapeutischer Anwendungen zu nutzen.
Dazu wurde innerhalb des COMAS eine Infrastruktur für die Lagerung und Testung einer Substanzbibliothek mit ca. 200.000 Substanzen geschaffen (Abb. 1). Substanzen mit einer identifizierten biologischen Wirkung können als molekulare Werkzeuge zur Validierung in der Grundlagenforschung oder als Ausgangspunkte für die medizinal-chemische Wirkstoffforschung dienen. Somit ist das COMAS ein wichtiger Meilenstein im Transfer von Know-How der Max-Planck-Gesellschaft in die Anwendung. Vergleichbare Programme wie die US NIH Roadmap und der Imperial Cancer Fund in Großbritannien demonstrieren die Notwendigkeit eines solchen Konzeptes. Das wissenschaftliche Gesamtziel von COMAS geht dabei weit über die Durchführung eines einzelnen Screening-Projekts hinaus. Erst durch die Meta-Analyse, der statistischen Analyse der Ergebnisse aus einer Reihe von Studien, kann ein nahezu vollständiges Bild der zellulären Wirkung einzelner Substanzen gezeichnet werden; es können synergistische Effekte und bislang unbekannte Interaktionen identifiziert werden.
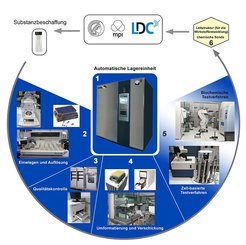
1) Das Kernelement des Substanzmanagements ist die automatische Lagereinheit. 2) Neue Substanzen werden eingewogen, im Lösungsmittel gelöst und in die Lagerröhrchen überführt. 3) Die Qualitätskontrolle erfolgt über chromatographische und visuelle Methoden. 4) Substanzen werden mit Hilfe eines Pipettierautomaten für biologische Testungen in eine Mikrotiterplatte überführt oder zum Verschicken vorbereitet. 5) Die Screening Plattform integriert verschiedene Geräte für zell-basierte und biochemische Testverfahren. Zelluläre Morphologien können mit einem Hochdurchsatzmikroskop ausgelesen werden. 6) Bioaktive Substanzen können weiter optimiert werden und treten erneut in den Test-Zyklus ein.
Public Private Partnership
Die in der Abteilung für Chemische Biologie (H. Waldmann) vorhandene Substanzsammlung bildete den Ausgangspunkt für die Konzeptionierung des COMAS. Ziel war die Implementierung einer zentralen Substanzmanagement- und Screening-Einheit innerhalb der Max-Planck-Gesellschaft. Dies geschah in enger Kooperation mit der Lead Discovery Center GmbH (LDC), einer Ausgründung von Max-Planck-Innovation. Das LDC stellt einen neuartigen Ansatzpunkt dar, um ausgezeichnete Ergebnisse im Bereich der Grundlagenforschung in die Entwicklung neuer Medikamente zu überführen. In den Aufbau von COMAS ist die Erfahrung vieler LDC-Experten bezüglich des Managements von chemischen Substanz-Bibliotheken und Screening eingeflossen. Sie hat es ermöglicht, COMAS innerhalb sehr kurzer Zeit vollständig und unter Einhaltung höchster Qualitätsstandards zu etablieren. Innerhalb einer fortlaufenden Forschungskooperation von COMAS und LDC wird der tägliche Betrieb der Anlagen gesichert. Nach einigen Jahren zeigt sich nun, dass erfolgreiche COMAS Projekte von höchster medizinischer Relevanz für die Weiterentwicklung in das LDC überführt werden können. So wird im LDC z.B. an einer neuen Generation von Modulatoren mit optimierten Eigenschaften für das Krebsprotein K-Ras gearbeitet, nachdem im COMAS das Hochdurchsatzprojekt abgeschlossen wurde [3, 4].
Infrastruktur auf dem neuesten Stand der Technik

Die aktuell circa 200.000 Substanzen umfassende COMAS-Substanzbibliothek wird in einem Hochdichtelagersystem bei -20°C unter Schutzatmosphäre aufbewahrt. Dies sichert die Stabilität der Proben für viele Jahre. In diesem Lagersystem werden für jede Substanz einzelne, bar-codierte Röhrchen verwendet, die innerhalb des Systems durch einen Robotergreifarm in Entnahmegestelle überführt werden. So können beliebige Zusammenstellungen von Substanzen aus dem System zur weiteren Analyse entnommen werden, ohne dass nicht-benötigte Proben mit aufgetaut werden müssen. Für die Durchführung von Screening-Projekten wurde die gesamte Substanz-Bibliothek auf Mikroplatten mit jeweils 1408 Substanzen aufgebracht. Aus diesen Mikroplatten wird innerhalb der Screening-Plattform jeweils ein winziges Testvolumen in die eigentliche Testplatte überführt. Dazu dient eine neue, ultraschallbasierte Dispensiertechnologie (akustisches Nanoliter-Dispensieren, vgl. Abbildung 2), die in den letzten Jahren in großen Pharmafirmen weltweit eine rasante Verbreitung gefunden hat.
Die Substanztestungen erfolgen innerhalb der neuen Screening-Plattform sowohl in vitro als auch mittels zellbasierter Verfahren. Diese stellen das physiologisch relevantere Test-System dar, weil sich die untersuchten Proteine in ihrer natürlichen Umgebung befinden. Parallel dazu werden Daten über die Zell-Toxizität der Substanzen erhoben. Für zellbasierte Verfahren stehen ein automatischer Zell-Inkubator und ein automatisches Mikroskop (Abb. 3) zur Verfügung. Um jede der 200.000 Substanzen einmal in einem zellbasierten Screening-Projekt zu untersuchen, werden mehrere Milliarden Zellen benötigt. Das geht weit über die Kapazität eines Forschungs-Zellkulturlabors hinaus. Dem COMAS ist es gelungen, die Zellanzucht in Hochdichte-Anzuchtbehältern zu etablieren, wie sie auch in der Industrie verwendet werden.

Um die Ergebnisse des Hochdurchsatz-Screenings effizient und schnell zu verarbeiten und mit vorhandenen Informationen über die Substanzen zu verknüpfen, wurde im COMAS ein speziell angepasstes und täglich aktualisiertes Datenbanksystem mit zugehöriger Analysesoftware installiert. Dieses bildet die Grundlage für die Postulierung von Struktur-Wirkungsbeziehungen für die gefundenen Substanzen und die Durchführung von Meta-Analysen.
Neuartige Ansätze für verschiedene Forschungsgebiete
Ein Schwerpunkt der COMAS Forschung liegt im Bereich der Krebsforschung. In den letzten Jahren konnten viele Modulatoren für bislang wenig untersuchte oder unbekannte Funktionsmechanismen identifiziert werden [5, 6]. Darüber hinaus wurde nach neuen Ansatzpunkten für die Antibiotika-Entwicklung [7] und die Infektionsforschung gesucht [8]. Aktuell unterstützt das COMAS fokussierte Screening-Projekte im Bereich der Kardiologie, Neurologie [9] und Diabetes. Dabei kommen innovative Technologien zum Einsatz, die auf pluripotenten Stammzellen basieren.
Eine wichtige Grundlage für die erfolgreiche Projektentwicklung am COMAS ist die enge Zusammenarbeit zwischen der MPI-Forschungsgruppe und den Screening-Experten am COMAS. Initial wird geprüft, ob das zu untersuchende biologische System auf die Roboteranlage übertragen werden kann. Mindestens ebenso wichtig ist es, einen Projektplan zu entwickeln, der die Charakterisierung und Priorisierung der erhaltenen potentiellen Wirkstoffe erlaubt. Insbesondere bietet das COMAS auch die Weiterentwicklung von Wirkstoffkandidaten durch chemische Optimierung an; eine notwendige Prozedur, wenn die initiale Wirkung der Substanzen nur schwach ist oder eine höhere Spezifität für ein zelluläres Zielprotein erzielt werden soll. Es können allerdings einige Jahre vergehen, bis aus den primären Ergebnissen eines Screenings validierte und gut charakterisierte Wirkstoffkandidaten geworden sind.
Literaturhinweise
Drug News & Perspectives 16, 93-102 (2003)
Chemical Communications 51, 925-928 (2015)
Journal of the American Chemical Society 137, 8475-8483 (2015)
Nature Chemical Biology 7, 75-7 (2011)
Chemistry & Biology 20, 500-9 (2013)


