Mit neofunktionalisierten Proteinen den Vererbungsprozessen auf der Spur
Forschungsbericht (importiert) 2017 - Max-Planck-Institut für molekulare Physiologie
Einleitung
Unser Erbmaterial, das Chromatin, besteht zu je etwa einem Drittel aus DNA, Histonen und weiteren Proteinen. Deren Zusammenspiel speichert einerseits alle biologische Information und organisiert lebenswichtige Prozesse, wie Transkription und Replikation, andererseits verpackt es das Genom, so dass es in den winzigen Zellkern passt. Um diese gegensätzlichen Anforderungen zu meistern, passt Chromatin seine Struktur und Zusammensetzung schnell an sich verändernde Bedingungen an. Besonders augenfällig ist die Bildung von mitotischen Chromosomen während der Zellteilung. Ein Prozess, der bis heute nur sehr unvollständig verstanden ist [1]. Forscher am Max-Planck-Institut für molekulare Physiologie entwickeln deshalb neue Strategien, mit denen es möglich ist, Wechselwirkungen im Chromatin noch in der lebenden Zelle "einzufrieren".
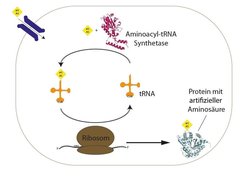
Dazu kommen modifizierte Aminosäureacyl-tRNA Synthetasen (Enzyme, welche die Beladung von Transfer-RNAs - tRNAs - mit den zugehörigen Aminosäuren bewerkstelligen) zum Einsatz. Diese Enzyme werden so verändert, dass sie eine artifizielle Aminosäure mit besonderen Eigenschaften binden und in das gewünschte Protein einbauen. Durch Bestrahlung können die Quervernetzer-Aminosäuren dazu gebracht werden, neue Bindungen mit benachbarten Molekülen (z.B. Interaktionspartnern) einzugehen. Dadurch werden diese Interaktionen "eingefroren" und können später mit biochemischen Methoden analysiert werden (Abb.1, [2]).
Chromatin-inhärente Anziehungskräfte unterstützen die Bildung von mitotischen Chromosomen

Abb. 2: Chromatin-inhärente Anziehungskräfte unterstützen die Bildung von mitotischen Chromosomen. Eine Wechselwirkung zwischen Nukleosomen induziert die Verdichtung von Chromatinfäden während der Mitose. Die Interaktion wird von einer Signalkaskade kontrolliert, die die Entfernung einer Acetylgruppe vom Aminoterminus von Histon H4 (Lysin-16) induziert. Damit wird der H4-Aminoterminus in die Lage versetzt, mit benachbarten Nukleosomen zu interagieren. Dies bewirkt eine zusätzliche Verdichtung des Chromatins, die dazu beiträgt, dass Chromosomen während der Teilung der Zelle nicht beschädigt werden.
Mit dem Eintritt in die Mitose beginnen Chromosomen sich zusammenzuziehen, um die charakteristische X-Form anzunehmen. Dieser Prozess wurde bereits vor mehr als 130 Jahren mikroskopisch beobachtet. Die zugrundeliegenden molekularen Prozesse sind jedoch bis heute nur partiell verstanden [1]. Eine zentrale Rolle spielen Condensine, die vermutlich große Chromatin-Schlaufen erzeugen, so dass sich Chromatinfäden zu wurstförmigen Strukturen verdichten. Es gibt jedoch Hinweise auf weitere Faktoren, die zu diesem Prozess beitragen.
Selbst in Abwesenheit zusätzlicher Faktoren besitzen Chromatinfäden die Fähigkeit, sich zusammen zu lagern. Mit Hilfe der genetisch codierten Quervernetzer-Aminosäuren konnte eine Interaktion zwischen zwei Histonen in benachbarten Nukleosomen, den kleinsten sich wiederholenden Einheiten des Chromatins, eingefangen werden [3]. Dadurch konnte gezeigt werden, dass diese Wechselwirkung zum Kondensationsprozess der Chromosomen während der Mitose in lebenden Hefezellen beiträgt.
Weitere Untersuchungen enthüllten eine Signalkaskade, die diese Wechselwirkung kontrolliert (Abb. 2). Außerhalb der Mitose wird sie durch die Modifikation eines der beteiligten Histone unterbunden. Zu Beginn der Mitose vermittelt die Phosphorylierung eines anderen Histons (durch die Haspin-Kinase und den Chromosomal Passenger Complex, CPC) die Rekrutierung eines Enzyms (Lysin-Deacetylase, Hst2), das diese Modifikation entfernt und damit die Wechselwirkung auslöst. Die Forscher konnten zeigen, dass diese Wechselwirkung eine zusätzliche Kondensation der Chromosomen anstößt, die unabhängig von der Funktion der Condensine ist [4]. Damit stellt die Zelle sicher, dass sich ihre Chromosomen ausreichend kontrahieren, damit sie während der Zellteilung nicht beschädigt werden.
Proteomanalyse von Chromatin in der lebenden Zelle
Interaktionen von Chromatin werden emsig erforscht, weil über sie viele essentielle Prozesse gesteuert werden. Manche Proteine erkennen bestimmte Kombinationen von Modifikationen der Histone oder werden von ihnen blockiert. Diese "Sprache" des Chromatins zu verstehen, ist eine der großen Herausforderungen im Feld der Epigenetik [5]. Leider ist Chromatin sehr "klebrig", denn es bindet unspezifisch viele andere Proteine, was die Interpretation der Interaktionsanalysen sehr erschwert.
Die Methode der Forschungsgruppe ermöglicht es, diese Interaktionen in der lebenden Zelle, und sogar während sich die Zelle in einem bestimmten Zustand befindet, "einzufrieren". Um die Identifikation der quervernetzten Interaktionspartner zu beschleunigen, wird diese Methodik mit moderner quantitativer Massenspektrometrie kombiniert.
Ausblick
Das Ziel künftiger Forschungen ist es, für jede einzelne Position, an der eine Quervernetzer-Aminosäure eingebaut wurde, sämtliche Interaktionspartner zu identifizieren. Diese Methode planen die Wissenschaftler auf das gesamte Nukleosom anzuwenden, um Informationen darüber zu gewinnen, wie es mit anderen Proteinen wechselwirkt. Die Quantifizierung der Interaktionen mittels Massenspektrometrie wird es ermöglichen, die Veränderungen in der Zusammensetzung des Chromatins in Abhängigkeit von Zellzyklus, posttranslationalen Modifikationen und der Struktur zu ermitteln. Dadurch wird man zu einem deutlich besseren Verständnis der molekularen Vorgänge während der Bildung von mitotischen Chromosomen gelangen.
Literaturhinweise
Current Opinion in Cell Biology 40, 15-22 (2016)
Current Opinion in Structural Biology 38, 119-128 (2016)
Science 343, 77-80 (2014)
Elife 4, e1039. (2015)
Science 293, 1074-1080 (2001)

