Wie Zellen ihre Umgebung wahrnehmen
Forschungsbericht (importiert) 2018 - Max-Planck-Institut für molekulare Physiologie
Haben Zellen ‚Sinnesorgane’, mit denen sie ihre Umgebung erfahren können? Unsere Abteilung erforscht mit experimentellen und theoretischen Forschungsansätzen, womit Zellen in der Lage sind, ihre komplexe Umgebung und deren zeitliche Veränderung zu erfassen und darauf angemessen zu reagieren. Wir konnten erstmalig zeigen, nach welchen Grundprinzipien die dynamischen Netzwerke aufgebaut und welche Eigenschaften der beteiligten Proteinnetzwerke für sie essentiell sind.
Einleitung
Unterschiedliche Zelltypen bilden extrazelluläre Wachstumssignale, sogenannte Wachstumsfaktoren. Diese binden an Rezeptoren wie den epidermalen Wachstumsfaktorrezeptor EGFR und lösen damit zelluläre Verhaltensweisen wie Zellvermehrung, Wanderung von Zellen, Überleben, Wachstum und Differenzierung aus. Bisher war jedoch unklar, wie ein einzelner Wachstumsfaktor so unterschiedliche Verhaltensweisen auslösen kann. Auch eine Vielzahl von Tumorerkrankungen geht mit einer fehlerhaften Regulation des Wachstumsfaktorrezeptors EGFR einher. Um wirklich zu verstehen, warum und wie solche Fehlregulationen von EGFR eine Tumorerkrankung begünstigen oder auslösen können und um dagegen gezielt pharmakologisch vorgehen zu können, müssen wir nicht nur das molekulare Verhalten von EGFR selbst verstehen, sondern auch das dynamische Verhalten des Signalnetzwerks, in das dieser Rezeptor eingebettet ist.
Ein Selbstverstärkungsmechanismus erhöht die Empfindlichkeit der zellulären Wahrnehmung
EGFR ist nicht nur ein Rezeptor, sondern auch eine membranständige Kinase, welche Informationen über die Anwesenheit von Wachstumsfaktoren in der Umgebung der Zelle in das Zellinnere weiterleitet. Kinasen sind Enzyme, die sich selbst und/oder andere Proteine mit einer Phosphatgruppe versehen. Diese angeheftete Phosphatgruppe erlaubt die Bindung weiterer Proteine und damit die Weiterleitung des Signals. Dass EGFR in der Lage ist, seine eigene Aktivierung in katalytischer Weise zu verstärken, konnten wir bereits vor geraumer Zeit zeigen, jedoch blieb der Mechanismus lange unklar. Mithilfe eines neuartigen Biosensors konnten wir nun nachweisen, dass die Anheftung einer Phosphatgruppe an eine Aminosäure im intrazellulären Teil von EGFR zu einem aktiven Zustand der Kinasedomäne im EGFR-Monomer und damit zur autokatalytischen Verstärkung der EGFR-Aktivität führt. Diese Verstärkung bewirkt, dass die Zelle selbst physiologisch sehr geringe Mengen an Wachstumsfaktor detektieren kann. Diese Art von Selbstverstärkungsmechanismus stellt eine allgemeine Eigenschaft auch von anderen Proteinen aus der Familie der Rezeptortyrosinkinasen dar und spielt daher für zelluläre Wahrnehmungsprozesse und ihre Entartung in Krebs eine große Rolle.
Die räumliche Verteilung von Signalen im Zellinneren ermöglicht der Zelle die ständige Interpretation ihrer Umgebung
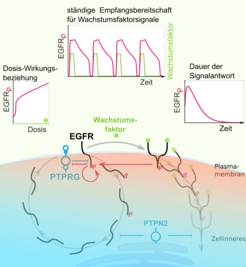
Abb. 1: Die räumliche Organisation des EGFR-Signalnetzwerks zwischen Plasmamembran und endosomalen Strukturen im Zellinneren gewährleistet eine ständige Antwortbereitschaft der Zelle auf Wachstumsfaktorsignale, regulierbare Dosis-Wirkungsbeziehungen und eine veränderbare Dauer der Signalantwort.
Kinasen wie EGFR agieren zusammen mit ihren Gegenspielern, den Phosphatasen, die signalgebende Phosphatgruppen wieder entfernen. Lange wurden Phosphatasen als einfache Signallöscher betrachtet. Mit einer raffinierten Kombination aus fluoreszenzmikroskopischen Einzelzellanalysen, biochemischen Experimenten und neu entwickelten Methoden aus der Nichtlinearen Dynamik haben wir untersucht, welche Phosphatasen wann und wo in der Zelle die Wachstumsfaktor-induzierte Aktivität von EGFR regulieren. Dabei konnten wir zeigen, dass die räumliche Verteilung von verschiedenen Phosphatasen über diverse Bereiche der Zelle, die über vesikulären Transport miteinander gekoppelt sind, für die Interpretation des Wachstumssignals und eine ständige Aufnahmebereitschaft für neue Signale wichtig ist.
Aktivierte EGFR-Moleküle werden durch Endozytose an der Plasmamembran in Vesikel verpackt und in das Innere der Zelle geleitet. Dabei werden die aktivierten EGFR-Moleküle zu unterschiedlicher Zeit an verschiedenen Orten der Zelle durch unterschiedliche Phosphatasen beeinträchtigt. Zum Beispiel bestimmt die Aktivität der Phosphatase PTPRG an der Plasmamembran, wie empfindlich EGFR der Zelle die Anwesenheit von Wachstumsfaktoren anzeigt. Die Phosphatase PTPN2 im Inneren der Zelle wiederum bestimmt, wie lange einmal aktiviertes EGFR in der Zelle aktiv bleibt, das heißt, wie lange ein externes Wachstumssignal in der Zelle ‚nachhallt’. Diese räumliche Organisation des EGFR-Signalnetzwerks gewährleistet, dass eine ständige Aufnahmebereitschaft der Zelle für Wachstumsfaktoren besteht und dass ab einer bestimmten Schwellenkonzentration von Wachstumsfaktor robuste, aber auch endliche zelluläre Signalantworten resultieren (Abb. 1). Dieses dynamische Netzwerk erklärt auch, wie unterschiedliche Konzentrationen von Wachstumsfaktor unterschiedliche Verhaltensweisen auslösen können. Wie wir im Folgenden sehen werden, stellt der Einfluss des vesikulären Austauschs zwischen verschiedenen Zellbereichen auf die Wahrnehmung von Wachstumsfaktorsignalen eine Schnittstelle dar, an der eine Anpassung der Signalantwort an die Umwelt stattfinden kann.
Der Kontakt mit benachbarten Zellen verändert die zelluläre Wahrnehmung

Abb. 2: Die Wundheilung erfordert das Einwandern von Zellen in den Wundbereich, gefolgt von ihrer Vermehrung, um die Wunde zu schließen. Beides wird durch den Wachstumsfaktor EGF angeregt. Welche der beiden Verhaltensweisen der Wachstumsfaktor auslöst, hängt davon ab, ob sich die Zelle in direktem Kontakt mit anderen befindet. Die Bilder zeigen, wie Zellen aus dem Randbereich einer Wunde unter Einfluss von Wachstumsfaktor in die Wunde (zellfreier Bereich in der Mitte) einwandern (links: vor Zugabe von Wachstumsfaktor, rechts: danach).
Lösliche Signale wie Wachstumsfaktoren, die manche Zellarten in die Umgebung aussenden, werden von einer Vielzahl anderer Zelltypen erkannt. Doch nicht alle Zellen eines Typs reagieren in gleicher Weise auf diese Signale. Wir haben untersucht, wie der direkte Kontakt zwischen Zellen ihre Antwort auf solche Wachstumsfaktorsignale verändern kann. Dabei konnten wir nachweisen, dass sogenannte Eph-Rezeptoren, durch die Zellen den direkten Kontakt mit anderen Zellen wahrnehmen, den Nachschub von empfangsbereitem EGFR an die Plasmamembran durch vesikuläres Recycling hemmen. Dies führt zu einer räumlichen Verschiebung der EGFR-Aktivität von der Plasmamembran hin zu endosomalen Strukturen im Inneren der Zelle, wodurch andere Signal-weiterleitende Proteine aktiviert werden. Durch die Eph-Rezeptor-induzierte Umschaltung wird das Bewegungsvermögen von Zellen gestoppt und ihr Wachstum angeschaltet. Wichtig ist dies ist zum Beispiel bei der Wundheilung, bei der erst Zellen in die Wunde einwandern müssen, um dann anschließend durch Vermehrung die Wunde zu schließen (Abb. 2).
Fazit
Unsere Forschung zeigt, wie lebende Systeme, anders als Computer, ihre Umgebung kognitiv erfassen. Diese kognitive Wahrnehmung entsteht aus Rückkopplungsmechanismen, der räumlichen Organisation und maßgeblich aus der Kommunikation der Zellen untereinander. Das Verständnis der molekularen Prinzipien des „sozialen Verhaltens“ von Zellen könnte es erlauben, neue Medikamente zu entwickeln, die das „unsoziale“ Verhalten von Krebszellen korrigieren können.

