Mitose, der Teilungsvorgang von Zellen und Chromosomen
Forschungsbericht (importiert) 2011 - Max-Planck-Institut für molekulare Physiologie
Einführung
Mitose und Meiose sind entscheidende Stadien im Zyklus eukaryotischer Zellen. In der Mitose werden die verdoppelten Chromosomen einer Mutterzelle gleichmäßig voneinander getrennt, um zwei Tochterzellen mit voller genetischer, komplementärer Ausstattung bilden zu können. Andererseits werden während der Meiose die verdoppelten Chromosomen durch Reduktion so geteilt, dass die homologen mütterlichen und väterlichen Chromosomenen zufällig auf die Keimzellen (Gameten) verteilt werden.
Aus molekularer Sicht sind Mitose und Meiose ähnliche, erstaunlich komplexe Prozesse. Als Mikrotubuli bekannte polymere Strukturen spielen in Mitose und Meiose eine zentrale Rolle. Mikrotubuli sind dynamische Biomoleküle, die durch Polymerisation eines Bausteins namens Tubulin entstehen. Sie interagieren mit einer reichen Palette verschiedener Proteine, wozu auch molekulare Maschinen (Motoren) gehören, die bereitgestellte Energie für den intrazellulären Transport verschiedenster Lasten nutzen und die Mikrotubuli als „Schienen“ verwenden.
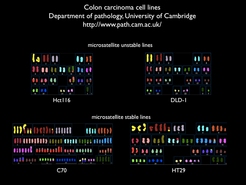
Mitose und Meiose haben weitreichende Auswirkungen auf die menschliche Gesundheit. Die Aneuploidie (die Anwesenheit eines überzähligen Chromosoms) ist in Tumoren eine viel zu häufige Abnormalität (Abb. 1). Man nimmt an, dass Aneuploidie eine Folge von Irrtümern während der Mitose ist. Es ist deshalb wichtig, die Ursache solcher Fehler zu verstehen und die Mechanismen zu untersuchen, die normale Zellen vor dem Auftreten dieser Fehler schützen. Die Probleme, die während der Meiose auftreten können, führen zu anderen Arten genetischer Abnormalität, so wie beispielsweise die Existenz einer zusätzlichen Kopie des Chromosoms 21 zum Down-Syndrom führt.
Die mitotische Spindel
In der Mitose und Meiose organisieren sich Nanometer-große Tubuline und ihre Bindungspartner selbst in eine als Spindel bezeichnete Struktur, die eine Größe von mehreren Mikrometern erreicht. Die Hauptfunktion der Spindel ist das Einfangen der Chromosomen und deren akkurate Aufreihung am Äquator der Zelle in der sogenannten Metaphasenplatte. Dieses Einfangen beginnt in der Prometaphase und schreitet fort, bis alle Chromosomen in der Metaphasenplatte angeordnet sind. Nach der Metaphase wandern die Chromosomen zu entgegengesetzten Polen der Zelle, ein Ereignis, das als Anaphase bezeichnet wird.
Bei der Mitose ist es von grundlegender Bedeutung zu verstehen, dass das Ziel dieses Prozesses die Trennung der replizierten Chromosomen ist. Nach der DNA-Replikation bestehen die Chromosomen aus je zwei identischen miteinander „verleimten“ Kopien desselben Chromosoms. Diese „verleimten“ Chromosomen werden als Schwesterchromatiden bezeichnet. Ein Cohesin genannter Proteinkomplex übt die anziehenden Kräfte aus, die die Schwesterchromatiden zusammenhalten. Die Schwesterchromatiden in jedem Paar verbinden sich mit Mikrotubuli, die an entgegengesetzten Polen der mitotischen Spindel entstehen, ein Vorgang, der Biorientierung genannt wird. Beim Übergang von der Meta- zur Anaphase verlieren die Schwesterchromatiden ihre Bindung, wenn der Cohesin-Komplex durch eine molekulare Schere (eine Protease namens Separase) gespalten wird, was den getrennten Schwestern die Wanderung zu den entgegengesetzten Zellpolen erlaubt. Dieser nur vordergründig einfache Trick gestattet Zellen, Chromosomen von genau der gleichen Zahl und gleichem Typ zu vererben. Die Grundlagen dieses Prozesses wiederum sind ziemlich komplex und noch kaum verstanden.
Kinetochoren verbinden Chromosomen mit Mikrotubuli
Wie Mikrotubuli Schwesternchromatide einfangen und eine stabile Bindung mit ihnen eingehen, wird gegenwärtig intensiv untersucht. Als Kinetochoren bezeichnete Proteingerüste spielen dabei eine wichtige Rolle [1].
Kinetochoren bilden sich an spezialisierten Regionen des Chromosoms, die als Zentromere bezeichnet werden, weil sie im Allgemeinen in der Mitte des Chromosoms liegen. Wie andere Regionen des Chromosoms enthält das Zentromer genetisches Material, die DNA. In den Chromosomen ist die DNA mit Histonen in sog. Nukleosomen organisiert, als molekulare „Perlen“, um die sich die DNA aufgrund komplexer molekularer Interaktionen dicht wickelt. An Zentromeren ist eines der “Perlenproteine”, Histone 3 (H3), durch einen molekularen Bruder namens CENP-A ersetzt. CENP-A markiert das Zentromer und ist letztendlich verantwortlich für den Zusammenbau des Kinetochors.
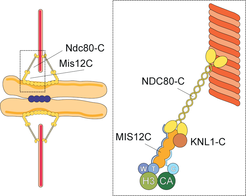
Mit über 100 verschiedenen Proteinen, jedes davon in vielfachen Kopien, stellen Kinetochore außerordentliche Komplexe dar. In Kinetochoren wiederum stellt das KMN-Netzwerk, ein Bauelement aus zehn Proteinen, die Kernbindestelle für die Mikrotubuli dar (KMN steht für die Anfangsbuchstaben von drei Unterkomplexen, Knl1, Mis12 und Ndc80) (Abb. 2), [2-4]. Innerhalb des KMN-Netzwerks enthält der Ndc80-Komplex eine Mikrotubulus-Bindestelle, die unabdingbar für die Trennung der Chromosomen ist. Ausführliche strukturelle und funktionelle Analysen haben zu einem fortgeschrittenen Verständnis der molekularen Mechanismen der Mikrotubulus-Bindung durch den Ndc80-Komplex sowie seiner Regulation geführt.
Kürzlich ist auch die Schnittstelle zwischen dem KMN-Netzwerk und den Chromosomen, die von einem makromolekularen Komplex namens CCAN (constitutive centromere associated network) bereitgestellt wird, in das Zentrum intensiver Untersuchungen gerückt [5].
Kinetochore und die Zellzyklus-Kontrollpunkte
Ein erstaunlicher Aspekt von Kinetochoren ist ihre Eigenschaft, die Mikrotubulus-Bindung mit der Bildung von Rückkopplungsmechanismen zu koordinieren, die einerseits das Weiterlaufen des Zellzyklus und andererseits die Genauigkeit beim Anheften des Kinetochors an den Mikrotubulus kontrollieren. Solche Rückkopplungsmechanismen sind bekannt unter der Bezeichnung “Kontrollpunkt des „Spindelzusammenbaus“ bzw. „Fehlerkorrektur“. Ihre Wichtigkeit ist einfach zu erklären: Die Ausschaltung der Fehlerkorrektur und der Kontrollpunkte führt zu Fehlern bei der Chromosomentrennung, wodurch Tochterzellen eine falsche Zahl von Chromosomen erben.
Der Spindel-Kontrollpunkt misst die Besetzung der Kinetochoren mit Mikrotubuli oder das Fehlen davon [6-9]. Es besteht Grund zur Annahme, dass die Fehlerkorrektur wiederum die Zugkräfte der Spindel an den Kinetochoren überwacht. Verbindungen des Kinetochors mit Mikrotubuli, die keine Spannung erzeugen, aktivieren einen Weg zur Korrektur, der schließlich die fehlerhaft gebundenen Mikrotubuli entfernt, damit den Fehler beseitigt und die Bildung neuer exakter Anheftungen fördert.

