Die Biosynthese von Phenazinen
Forschungsbericht (importiert) 2005 - Max-Planck-Institut für molekulare Physiologie
Phenazinderivate in pathogenen Keimen
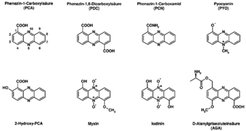
Phenazine sind stickstoffhaltige aromatische Verbindungen, die von vielen Bakterien synthetisiert und in das umgebende Medium abgegeben werden. Sie besitzen antibiotische Aktivität, da sie aufgrund ihrer elektrochemischen Eigenschaften Sauerstoff durch Reduktion aktivieren können und somit eine toxische Wirkung auf empfindliche Zellen besitzen. Die Synthese von Phenazinen verschafft den sie produzierenden Bakterien somit einen kompetitiven Vorteil bei der Besiedlung und Verteidigung ihres Lebensraumes. Zusätzlich spielen einige Phenazin-Derivate eine wichtige Rolle in bakteriellen Infektionskrankheiten. Ein Beispiel ist das blaue Phenazinpigment Pyocyanin, das von Pseudomonas aeruginosa synthetisiert wird, einem wichtigen pathogenen Bakterium, das zu chronischen Lungeninfektionen bei 95 Prozent aller Mukoviszidose-Patienten führt und eine der Hauptursachen für Krankenhausinfektionen darstellt. Pyocyanin trägt über verschiedene Mechanismen zur Gewebeschädigung bei. Im Mausmodell konnte gezeigt werden, dass das Immunsystem P. aeruginosa besser bekämpfen kann, wenn dessen Pyocyanin-Produktion beeinträchtigt ist.
Mehr als 50 in der Natur vorkommende Phenazinderivate sind bekannt; eine Auswahl ist in Abbildung 1 gezeigt.
Enzymatik der Phenazin-Biosynthese
Obwohl das Phänomen der bakteriellen Phenazin-Biosynthese erstmals bereits um 1850 in der wissenschaftlichen Literatur beschrieben wurde, sind wesentliche Details nicht aufgeklärt. Das Team um Wulf Blankenfeld hat es sich zur Aufgabe gemacht, diese Wissenslücke mit einer Kombination aus biochemischen und strukturbiologischen Methoden zu schließen.

Die Biosynthese von Phenazinen ist ein Nebenzweig der aromatischen Aminosäurebiosynthese. Mit radioaktiv markierten Verbindungen wurde in den 1970er-Jahren gezeigt, dass das Phenazingerüst in einer nicht näher charakterisierten Dimerisierung von zwei Chorismatmolekülen (Strukturformel siehe Abb. 4)gebildet wird [1]. Das hierfür verantwortliche phz-Operon, das in dem verwendeten Modellorganismus Pseudomonas fluorescens 2-79 die sieben Gene phzA-G enthält, wurde schließlich im Jahr 1998 erstmals vollständig sequenziert [2]. Von den Produkten dieser sieben Gene werden offenbar fünf Reaktionen katalysiert, die Chorismat in Phenazin-1-Carboxylat (PCA) umwandeln. PCA stellt wahrscheinlich die gemeinsame Vorstufe für die weitere Modifizierung zu stammspezifischen Phenazinderivaten dar.
Durch Sequenzvergleiche und Versuche mit Zellextrakten aus E. coli-Bakterien, die Teile des phz-Operons exprimieren, zeigten die Forscher, dass Chorismat von PhzE zu 2-Amino-4-desoxychorismat (ADIC) umgesetzt wird. PhzE gehört zur Familie der Anthranilatsynthasen, katalysiert aber nicht wie diese die Weiterumsetzung von ADIC zu Anthranilat. In der Phenazin-Biosynthese wird ADIC durch PhzD zu 2,3-Dihydro-3-hydroxyanthranilat (DHHA) gespalten. Die Funktion der übrigen Enzyme PhzA, PhzB, PhzF und PhzG war zu Beginn der eigenen Untersuchungen nicht geklärt [3].
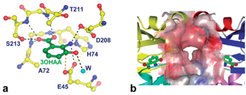
Die Dortmunder Arbeitsgruppe hat die Phz-Enzyme aus P. fluorescens 2-79 rekombinant produziert und die Strukturen von PhzA, PhzD, PhzF und PhzG kristallografisch bestimmt (Abb. 2) [4-6].
Zusätzlich zur Strukturbestimmung wurden kernresonanz- und massenspektrometrische Experimente durchgeführt, die zeigen, dass PhzF Isomerasefunktion besitzt und 2,3-Dihydro-3-hydroxyanthranilat durch eine [1,5]-Protonenverschiebung in das korrespondierende Keton 2 überführt. Die Untersuchungen liefern zudem Hinweise darauf, dass das Keton spontan – wahrscheinlich unter Bildung einer doppelten Schiff’schen Base – zur Phenazin-Vorstufe 3 dimerisiert. Diese Reaktion könnte ebenfalls durch PhzF unterstützt werden, indem zwei Ketonmoleküle nach Verlassen der beiden aktiven Zentren des PhzF-Dimers in einem relativ abgeschlossenen Raum zwischen den Monomeren zusammengeführt werden (Abb. 3).
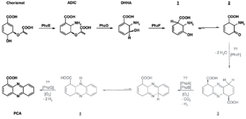
Zur großen Überraschung der Forscher bleibt die Umsetzung von 2,3-Dihydro-3-hydroxyanthranilat auch auf der Stufe des Zwischenprodukts 3 nicht stehen, sondern es kommt zu einer spontanen oxidativen Decarboxylierung mit einem Produkt, das wahrscheinlich der Struktur 4 entspricht (Abb. 4). Diese Reaktion könnte durch den mit der teilweisen Aromatisierung einhergehenden Stabilitätsgewinn angetrieben werden und liefert einen ersten Hinweis darauf, warum in der bakteriellen Phenazinsynthese in der Regel Phenazin-1-Carboxylsäure und nicht Phenazin-1,6-Dicarboxylsäure als erste stabile Phenazinverbindung erzeugt wird. Massenspektroskopische Versuche und Experimente zur Bestimmung der Sauerstoffkonzentration zeigen an, dass dieser Schritt auch katalysiert unter Beteiligung von PhzB erfolgen kann und dass Sauerstoff in dieser Reaktion als Elektronenakzeptor fungiert. Dies ist insofern überraschend, als PhzB keinen Cofaktor enthält, der mit Sauerstoff interagieren könnte.
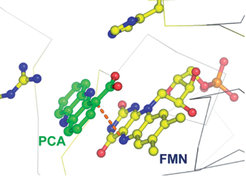
Um zur Phenazincarboxylsäure umgewandelt zu werden, muss das Zwischenprodukt 4 noch zwei weitere Zwei-Elektronen-Oxidationen durchlaufen. Eine dieser Oxidationen wird mit Sicherheit von PhzG katalysiert, einem Flavinmononucleotid (FMN)-bindenden Enzym, das mit Pyridoxamin-Oxidase verwandt ist. Die in Dortmund bestimmte Struktur von PhzG im Komplex mit Phenazincarboxylsäure zeigt, dass das Enzym ein tricylisches, phenazinähnliches Substrat am Kohlenstoffatom 1 oxidiert (Abb. 5).
Es ist möglich, dass die abschließende Oxidation zur Phenazincarboxylsäure direkt durch Sauerstoff erfolgt, ähnlich der Regeneration des Cofaktors in FMN-abhängigen Enzymen. Für die Phenazin-Biosynthese ergibt sich somit der in Abbildung 4 wiedergegebene Reaktionsweg. Die Wissenschaftler am MPI für molekulare Physiologie werden ihre Versuche in Zukunft auf die Untersuchung der Biosynthese in denjenigen Spezies ausdehnen, für die Phenazin-1,6-Dicarboxylsäure als erste stabile Phenazinverbindung angenommen wird. Hierdurch wollen sie weitere Einblicke in die ungewöhnliche PhzB-katalysierte Decarboxylierungsreaktion erhalten.




