Struktur und molekulare Mechanismen von Uhrenproteinen
Forschungsbericht (importiert) 2004 - Max-Planck-Institut für molekulare Physiologie
Zirkadiane Rhythmen und zirkadiane Uhren
Alle Lebewesen unterliegen biologischen Rhythmen, d. h. biologischen Phänomenen, die sich in regelmäßigen Zeitabständen wie zum Beispiel einem Tag, Monat oder Jahr wiederholen. Tagesperiodische (24h-) Rhythmen, die sich durch Adaptation an den Tag-Nacht-Zyklus auf der Erde entwickelt haben, werden als zirkadiane Rhythmen bezeichnet (circa diem, lat.: ungefähr ein Tag). Viele biochemische und physiologische Prozesse wie auch zahlreiche Verhaltensweisen eines Organismus sind zirkadianen Rhythmen unterworfen. Beim Menschen werden unter anderen der Schlaf- und Wachzustand, die Körpertemperatur, der Blutdruck sowie Hormon- und Immunsystem zirkadian reguliert. Als Folge dieser Tagesschwankungen treten beispielsweise Asthmaanfälle, Arthritis-Symptome, Herzinfarkte, Schlaganfälle oder allergische Reaktionen zu bestimmten Tageszeiten gehäuft auf. Entsprechend entfalten viele Medikamente nur bei Einnahme zur „richtigen“ Tageszeit ihre optimale Wirkung.
Zirkadiane Rhythmen werden durch innere biologische Uhren (zirkadiane Zeitmesssysteme) erzeugt. Dabei handelt es sich um tagesperiodisch schwingende zirkadiane Oszillatoren, die durch externe „Zeitgeber“-Signale wie Licht oder Temperatur mit dem Tag-Nacht-Zyklus der Umgebung synchronisiert werden und rhythmische Ausgangssignale erzeugen (Abb. 1). Bei Säugetieren ist der wichtigste Zeitgeber das Tageslicht, welches durch spezielle zirkadiane Photorezeptoren wahrgenommen wird. Die tagesrhythmischen Ausgangssignale erzeugen das mit der Außenwelt synchronisierte zirkadiane Aktivitätsmuster.
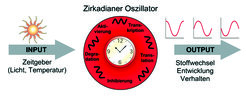
Proteine in der zirkadianen Zeitmessung
Bei allen bislang untersuchten Organismen der Tier- und Pflanzenwelt und den Cyanobakterien (Blaualgen) werden die zirkadianen Oszillatoren durch Rückkopplungsschleifen der Transkription und Translation angetrieben, deren Schwingungsfrequenz auch ohne äußeren Zeitgeber etwa 24 Stunden beträgt [1]. Dabei ist die endogene Periodik genetisch determiniert und beträgt beim Menschen etwa 24,5 bis 25 h, bei der Maus hingegen durchschnittlich nur 23,7 h. Entscheidend für die Erzeugung und Aufrechterhaltung der endogenen 24h-Periode ist ein präzises Zusammenspiel der tagesperiodischen Synthese, der Modifikation und des Abbaus von zentralen Uhrenproteinen im Rahmen ihrer spezifischen Protein-Protein- und Protein-Nukleinsäure-Wechselwirkungen.
Hauptziel der Dortmunder Forscher im Bereich der zirkadianen Rhythmik ist die Bestimmung der Röntgenkristallstrukturen von zentralen Uhrenproteinen und zirkadianen Photorezeptoren sowie von deren höhermolekularen Komplexen. Durch die Kombination struktureller und biochemisch/biophysikalischer Untersuchungen erhalten die Wissenschaftler Einblick in die molekularen Mechanismen, die der Erzeugung zirkadianer Rhythmen sowie deren Synchronisation mit dem Hell-Dunkel-Zyklus der Umgebung zugrunde liegen. Letztendlich soll dadurch eine strukturelle Basis für die Entwicklung von Medikamenten gegen Schlafstörungen, Jetlag, Folgen von Schichtarbeit, durch unregelmäßigen Schlaf hervorgerufene Depressionen sowie krankhafte Funktionsstörungen der inneren Uhr geschaffen werden. Ferner ist ein detailliertes mechanistisches Verständnis der inneren Uhr für die Chronopharmakologie (Biorhythmik der Arzneimittelwirkungen) und Chronotherapie (Anwendung von Medikamenten zu optimalen Tageszeiten) von großer Bedeutung.
Der zirkadiane Oszillator von Drosophila und Maus
Bei Tieren wurde der molekulare Aufbau der zirkadianen Uhr bislang überwiegend in dem Modellorganismus Drosophila melanogaster (Taufliege) und bei der Maus als Vertreter der Säugetiere untersucht (Abb. 2). Bei Drosophila wurden als negative Elemente der Rückkopplungsschleife des zirkadianen Oszillators die Proteine PERIOD und TIMELESS, bei Säugetieren die Proteine PERIOD 1 und 2 sowie CRYPTOCHROM 1 und 2 identifiziert. Als positive Elemente wirken bei Drosophila die Transkriptionsfaktoren dCLOCK und CYCLE, bei den Säugetieren die homologen Proteine mCLOCK und BMAL1. Die Stabilität, zelluläre Lokalisation und Aktivität der negativen Elemente wird bei Drosophila und bei Säugetieren durch für die einzelnen Uhrenproteine spezifische Kinasen reguliert. Allerdings ist ein deutlicher Unterschied in der Funktion der Cryptochrome von Drosophila und den Säugetieren zu beobachten: Während die Säugetier-Cryptochrome eine zelluläre lichtunabhängige Rolle als negative Elemente der Rückkopplungsschleife spielen, ist das Drosophila-Cryptochrom ein zirkadianer Blaulicht-Photorezeptor, der die Synchronisation der inneren Uhr mit dem Hell-Dunkel-Zyklus der Umgebung vermittelt. Die Funktion der Cryptochrome im zentralen Oszillator wird daher bei Drosophila von TIMELESS übernommen, welches im Säugetier keine Rolle zu spielen scheint. Die Veränderung der Funktion der Cryptochrome im Laufe der Evolution ist dadurch zu erklären, dass die das zirkadiane Verhalten steuernde „Zentraluhr“ der Säugetiere in dem so genannten Suprachiasmatischen Nukleus im Hypothalamusbereich des Gehirns angesiedelt und damit dem Licht nicht direkt zugänglich ist. Insgesamt weist die zirkadiane Uhr von Drosophila jedoch viele Gemeinsamkeiten mit der Säugetier-Uhr auf. Durch die molekularbiologische, biochemische und biophysikalische Charakterisierung von Uhrenkomponenten der Drosophila-Fliege können somit wertvolle Hinweise auf die Funktion der homologen Proteine in der inneren Uhr des Menschen gewonnen werden.

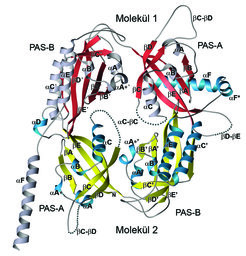
Die Struktur der PAS-Region von Drosophila-PERIOD
Kürzlich haben Wissenschaftler der Abteilung Strukturelle Biologie des Dortmunder Max-Planck-Instituts die dreidimensionale Struktur eines Fragments des Drosophila-PERIOD-Proteins ermittelt, welches zwei so genannte PAS-Domänen (PAS-A und PAS-B) enthält (Abb. 3), [2]. PAS-Domänen sind in der Natur sehr häufig vorkommende Signaltransduktionsdomänen, die entweder sensorische Funktionen erfüllen oder, wie im Falle der PERIOD-Proteine, Protein-Protein-Wechselwirkungen vermitteln. Die röntgenkristallografisch ermittelte Struktur ist die erste Darstellung eines eukaryontischen Uhrenproteins und zeigt erstmalig, wie eine Struktur aus zwei hintereinander liegenden PAS-Domänen aufgebaut ist. Derartige Wiederholungen kommen auch in den Transkriptionsfaktoren der inneren Uhr und einigen biomedizinisch bedeutenden Transkriptionsfaktoren wie dem Dioxinrezeptor und dem Hypoxie-Induzierbaren Faktor α vor. In der PERIOD-Struktur bildet sich zudem ein kompaktes, über die PAS-Domänen vermitteltes Dimer aus. Neben intermolekularen Kontakten zwischen den PAS-Domänen wird das Dimer durch die Wechselwirkung der PAS-A-Domäne von Molekül 1 mit einer carboxyterminal der PAS-B-Domäne gelegenen α-Helix in Molekül 2 stabilisiert. Die funktionelle Bedeutung dieses „Kristall“-Dimers konnten die Wissenschaftler durch biochemische Charakterisierung von PERIOD-Mutanten mit veränderten Dimerkontaktflächen nachweisen.
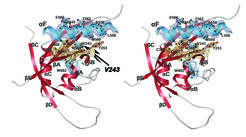
Beeinflussung der Tagesperiodik durch Mutation im PERIOD-Protein
Die PERIOD-Struktur hat auch Einblicke in den Mechanismus einer Mutation geliefert, die bei lebenden Taufliegen zu einem verlängerten Tagesrhythmus von 29 anstelle von 24 Stunden führt. In diesen Mutanten ist nur ein einziger Aminosäurerest an der Oberfläche der PAS-A-Domäne verändert (Austausch von Valin gegen Asparaginsäure an der Position 243). Anhand der PERIOD-Struktur und komplementärer Dimerisierungsstudien konnten die Dortmunder Wissenschaftler nun zeigen, dass der gravierende Einfluss dieser Mutation auf die zirkadiane Rhythmik (Tageslänge) der Taufliege durch eine Destabilisierung der intermolekularen Wechselwirkungen zwischen der PAS-A-Domäne und der Helix αF von PERIOD hervorgerufen wird (Abb. 4). Dadurch könnten neben der Verhinderung der Selbstassoziation von PERIOD- Molekülen zu Homodimeren auch viele andere Prozesse in der inneren Uhr beeinflusst werden. Beispiele dafür sind die Wechselwirkung von PERIOD mit Transkriptionsfaktorkomplexen, die Regulation von PERIOD durch Phosphorylierung oder auch die tagesperiodische Wanderung von PERIOD zwischen Zellkern und Zytoplasma.
Die PERIOD-Struktur liefert Einblicke in den zirkadianen Oszillator der Säugetiere
Sequenzvergleiche deuten darauf hin, dass die in der PERIOD-Struktur beobachteten Dimerkontaktflächen der PAS-Domänen strukturell in den PERIOD-PERIOD-Komplexen des Säugetier-Oszillators konserviert sind. Im Mausoszillator wurde die Rolle der PAS-Domänen bei der Dimerisierung von PERIOD-Proteinen bereits mehrfach nachgewiesen. Außerdem konnte gezeigt werden, dass eine Deletion weiter Teile der PAS-B-Domäne von PERIOD 2 bei Mäusen zu einer verkürzten Periode von etwa 22 h und einem Verlust der endogenen zirkadianen Periodik in Dunkelheit führt. Durch biochemische Analyse gereinigter PAS-Wiederholungs-Fragmente von PERIOD 2 und gezielte Mutagenese zeigten die Dortmunder Wissenschaftler nun, dass auch die PAS-Wiederholungs-Region von PERIOD 2 in Lösung Dimere bildet, die wahrscheinlich durch die in der Drosophila PERIOD-Struktur beobachteten Dimerkontaktflächen der PAS-Domänen vermittelt werden. Somit könnte die in der Struktur beobachtete Dimerkontaktfläche auch eine wichtige Rolle bei der Regulation der inneren Uhr des Menschen spielen.
Interessanterweise wurde die biomedizinische Bedeutung des Maus PERIOD2-Moleküls als wesentlicher Bestandteil der inneren Uhr bereits mehrfach dokumentiert. Beispielsweise hat eine Punktmutation in dem analogen humanen Gen, die zur Entfernung einer Phosphorylierungsstelle führt, die Ausprägung des Familiären Advanced Sleep Phase Syndroms (FASPS) zur Folge. FASPS-Patienten erwachen und ermüden sehr frühzeitig, da ihre innere Uhr gegenüber dem äußeren Tagesablauf um etwa vier Stunden vorgeht. Des Weiteren unterliegen Mäuse, die in beiden Kopien des Gens für PERIOD 2 die oben genannte PAS-B-Deletionsmutation tragen, einem erhöhten Krebsrisiko sowie einer erhöhten Suchtgefahr für Alkohol und Kokain.
Mit der Bestimmung der Röntgenstruktur der PAS-Wiederholungs-Region von Drosophila-PERIOD und der darauf basierenden Analyse von Protein-Protein-Wechselwirkungen der Drosophila- und Maus-PERIOD-Proteine gelang es den Dortmundern Wissenschaftlern um Alfred Wittinghofer, auf atomarer Ebene Einblicke in Bereiche der inneren Uhr zu erhalten, die Einfluss auf verschiedenste Krankheitsbilder haben. Durch die strukturelle und biochemisch/biophysikalische Charakterisierung weiterer Uhrenproteine sollen in Zukunft noch weitreichendere mechanistische Einblicke in das Räderwerk der biologischen Uhr gewonnen werden.



