Die Jagd nach der idealen Synthese
Forschungsbericht (importiert) 2012 - Max-Planck-Institut für molekulare Physiologie
Die Entwicklung von neuen effizienten Synthesemethoden ist ein Gebiet von großer Bedeutung. Wissenschaftler vom MPI für molekulare Physiologie beschreiben neue Wege für den schnellen Zugriff auf chemische Stoffe. Diese Methoden zeichnen sich durch milde, metallfreie und die Umwelt schonende Verfahren aus.
Einführung
Niedermolekulare organische Verbindungen sind für die Forschung in den Biowissenschaften unabdingbar geworden. Die Entwicklung von Methoden zur Synthese bioaktiver Moleküle und das Studium ihrer Eigenschaften ist eine treibende Kraft hinter den Fortschritten in Physik und Materialwissenschaften, in Biologie und Medizin.
Grüne Chemie
In letzter Zeit wurden neue Regeln für die Entwicklung von Synthesemethoden aufgestellt, die als “Die 12 Prinzipien der Grünen Chemie” [1] bezeichnet werden. Diese Prinzipien zielen darauf ab, Methoden mit reduzierter Abfallproduktion, geringerer Giftigkeit für Mensch und Umwelt, aber auch mit maximalem Einbau aller Rohmaterialien in das Endprodukt zu etablieren. Um diese Philosophie umzusetzen, erfuhren einige Gebiete der organischen Synthese, wie Katalyse, metallfreie Synthese und die Funktionalisierung der Kohlenstoff-Wasserstoff-Bindung, in den letzten Jahren wachsende Aufmerksamkeit. Katalytische Herangehensweisen, die auf der Verwendung geringer Reagenzmengen beruhen, werden ihrer ökonomischen Vorteile wegen bevorzugt. Für die Herstellung organischer elektronischer Bauteile und medizinischer Wirkstoffe werden Verbindungen von sehr hoher Reinheit benötigt, in denen geringste Spuren an Metall zu dramatischen Veränderungen ihrer Eigenschaften führen.
Metallfreie Katalyse
Die Entwicklung metallfreier katalytischer Verfahren erlaubt den Zugriff auf hochreine chemische Verbindungen ohne die genannten unerwünschten Eigenschaften. Die geringere Giftigkeit dieser Prozesse ist weitaus umweltschonender als traditionelle Methoden, die auf der schrittweisen Transformation aktivierter Verbindungen beruhen. Die neuen Verfahren, bei denen direkt Atome wie Stickstoff in Kohlenstoff-Wasserstoff-Bindungen eingebaut werden, brauchen keine unnötigen Derivatisierungsschritte und die schnelle Bildung des gewünschten Produkts erfolgt mit einem Minimum an Syntheseschritten. Die geringere Anzahl einzelner Schritte mimimiert bei der direkten Funktionalisierung der C-H-Bindung ebenfalls die Abfallproduktion erheblich.
Während des letzten Jahrhunderts wurden eine Menge verschiedener Methoden in der organischen Synthese entwickelt und mit ihrer Hilfe steht eine große Palette an Produkten zur Verfügung. Aber nach wie vor ist es äußerst wichtig, die Entwicklung organischer Synthesen voranzutreiben, um sowohl die maximale Ausbeute in der Synthese zu erreichen als auch die Eigenschaften neuer Verbindungen studieren zu können.
Neues Leben für ein altes Reagenz
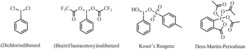
Jod tritt in Verbindungen zumeist in monovalenter Form auf. Allerdings bildet es auch stabile multivalente Bindungen aus. Die erste hypervalente organische Jodverbindung, Dichlorjodbenzol (Abb. 1), wurde 1886 von dem deutschen Chemiker Conrad Willgerodt dargestellt. Obwohl die oxidierenden Eigenschaften der Verbindung seit 1893 bekannt waren, erfuhr sie erst in den letzten Jahren eine Renaissance im Arbeitsbereich des hypervalenten Jods [2]. Obwohl die chemischen Eigenschaften und die Reaktivität hypervalenter Jodverbindungen denen von Schwermetallen wie Quecksilber, Thallium oder Blei ähneln, sind sie nicht giftig, sondern umweltfreundlich. Auch die ständige Verfügbarkeit und einfache Handhabung machen sie zu nützlichen Synthesewerkzeugen. Die Derivate können unter milden Reaktionsbedingungen, zum Beispiel bei Raumtemperatur und Luftzufuhr, eingesetzt werden.
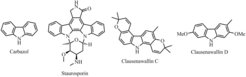
Organokatalytische Synthese von Carbazolen
Carbazolalkaloide sind in der Natur weit verbreitet (Abb. 2) [3]. Sie zeigen ein breites Spektrum biologischer Aktivität, das z. B. beim Staurosporin von der Wirkung gegen Pilze bis zur Beeinflussung des Bluthochdrucks reicht. Der Befund, dass Staurosporin ein sehr potenter Inhibitor von Proteinkinasen ist, macht das Grundgerüst der Carbazole sehr attraktiv für Studien in der Chemischen Biologie. Das Ziel des hier vorgestellten Projekts ist die Entwicklung neuer milder Synthesemethoden mittels direkter Funktionalisierung der Kohlenstoff-Wasserstoff-Bindung [4]. Das unter diesen Vorgaben entwickelte neue Syntheseverfahren erlaubte die Synthese verschiedener Carbazole, wobei selbst die Anzahl von an der Reaktion beteiligten Atomen ökonomisch gestaltet werden konnte. Diese Verbindungen werden z. Zt. auf ihre biologische Wirksamkeit geprüft. Mit der Entwicklung der organokatalytischen Carbazolsynthesen gelang eine Entdeckung, die den Hintergrund für die zukünftige Forschung an der selektiven Bildung von intermolekularen Kohlenstoff-Stickstoff-Bindungen bildet. Die neue Methode erlaubt den effizienten Zugriff auf zahlreiche biologisch aktive Verbindungen und ist geeignet, Naturprodukte in vielfältiger Weise zu modifizieren [5, 6].
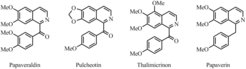
Die ideale Synthese
Oft sind Naturprodukte Ausgangspunkte in der biologischen Forschung. Viele Arzneistoffe sind Naturprodukte oder von solchen abgeleitet. Aber Naturprodukte lassen sich nicht problemlos in großen Mengen und hoher Reinheit isolieren, und das beschleunigt die Entwicklung synthetischer Methoden für solche Verbindungen. Die Effizienz der Synthesen zu erhöhen, bleibt eine Herausforderung. 1975 definierte James Hendrickson die ideale Synthese als eine, die “ein komplexes Molekül … in einer Abfolge von ausschließlich konstruktiven Reaktionen entstehen lässt, wobei keine intermediären Zwischenprodukte entstehen, und direkt zur Zielverbindung führt, nicht nur zu seinem Gerüst, sondern auch zu seinen korrekt angeordneten funktionellen Gruppen.” [7] Eine ideale Synthese nutzt darüber hinaus die Prinzipien der Grünen Chemie. Die Reaktivitäten hypervalenter Jodverbindungen gaben die Anregung, Untersuchungen zur Synthese von grundlegenden Naturprodukten aus einfachen Ausgangsmaterialien anzustellen (Abb. 3). Insbesondere die Synthese von Naturprodukten aus kostengünstigen kommerziellen Materialien in nur einem Schritt ist hervorzuheben [8].