Anti-Aging fürs Zellskelett mit therapeutischem Potential
Forschungsbericht (importiert) 2021 - Max-Planck-Institut für molekulare Physiologie
Elektronenmikroskopie konnten wir nun erstmalig aufklären, wie zwei natürliche Giftstoffe die Regulation des Zellskeletts beeinflussen. Während diese Stoffe bereits heute von großem Nutzen für die Forschung sind, könnten sie in Zukunft sogar dazu eingesetzt werden, das Zytoskelett von Krebszellen gezielt zu verkleben und die Zellen auf diese Weise abzutöten.
Einleitung
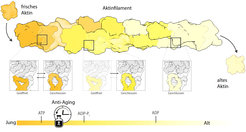
Adenosindiphosphat und einen abgespaltenen Phosphatrest (ADP-Pi, gelb) und bei altem Aktin Adenosindiphosphat (ADP, hellgelb). Mit zunehmendem Alter geht eine schleifenförmige Struktur auf der Oberfläche des Filaments von einer flexiblen, teils offenen, teils geschlossenen Form in einen vollständig geschlossenen Zustand über. Der Alterungsprozess kann mit Toxinen gestoppt werden, die das Aktin binden und stabilisieren.
Beim mikroskopischen Blick in eine menschliche Zelle fallen sogleich eine Vielzahl langer dünner Fasern direkt unterhalb der Membran auf. Sie bilden ein komplexes Netz, das Zellskelett, das sich über die ganze Zelle erstreckt und ihr die nötige Stabilität und Form verleiht. Ein Teil der Fasern sieht aus wie zwei umeinander gewundene Perlenketten. Bei den „Perlen“ handelt es sich um Aktin, ein in der Evolution altbewährtes Strukturprotein, das gleichzeitig eines der häufigsten Proteine in der Zelle ist. In Muskelzellen ist es zusammen mit anderen Proteinen für die Kontraktion und Entspannung des Muskels verantwortlich. Außerhalb des Muskels sind die Fasern, die Aktinfilamente genannt werden, an vielen weiteren lebenswichtigen Aufgaben beteiligt, wie z. B. an der Zellteilung und am Stofftransport innerhalb der Zelle.
All diese Aufgaben verlangen dem Aktinskelett eine hohe Flexibilität ab. Um diese zu gewährleisten, unterliegen Aktinfilamente ständigen Auf- und Abbauprozessen: Während an einem Ende der Faser alte Aktinmoleküle abgebaut werden, heftet am anderen Ende frisches Aktin an. So wandert ein Aktinmolekül durch die ganze Faser. Wächst die Faser dabei in Richtung Zellwand, entstehen außerdem physikalische Kräfte, welche die Membran verschieben und somit zur Zellbewegung führen. Stabilität, Formgebung, Transport und Bewegung - Aktin ist ein wahres Multitalent. Doch wie schafft ein einzelnes Protein all das?
Viele kleine Helfer erkennen das lokale Alter von Aktinfilamenten
Aktin hat seine vielen Talente einer Menge Aktin-bindender Proteine zu verdanken - kleine Helfer, die den Auf- und Umbau des Aktinskeletts steuern. So gibt es beispielsweise Nukleationsfaktoren, die die Neubildung eines Aktinfilaments fördern, oder auch Proteine, die beim gezielten Abbau des Filaments helfen. Während bereits bekannt war, dass sich viele Helfer am lokalen Alter des Aktinfilaments orientieren, war unklar, wie sie das genau machen. Mithilfe der Kryo-Elektronenmikroskopie (Kryo-EM) konnten wir nun erstmals Aktinfilamente unterschiedlichen Alters im nahezu atomaren Bereich auflösen und so zeigen, dass sich die Struktur der Aktinmoleküle mit dem Alter ändert, je nachdem, wie lange sich das Molekül schon im Filament befindet. Die verstrichene Zeit wird dabei anhand des biochemischen Zustands des „molekularen Treibstoffs“ Adenosintriphosphat (ATP) gemessen. Heftet sich ein neues Aktinmolekül an das Filament an, verändert sich dessen Struktur und die Spaltung des ATP wird in Gang setzt. Hierbei wird zunächst ein Phosphatrest (Pi) vom ATP abgetrennt, der jedoch noch einige Zeit im Aktin gebunden bleibt. Später wird der Phosphatrest freigesetzt, was zu einer Destabilisierung des gealterten Filaments führt.
Wir konnten nun zeigen, dass der biochemische Zustand des ATP an die Struktur des Aktins geknüpft ist, sodass sich diese ebenfalls mit der Zeit ändert. Eine besondere Rolle spielt dabei eine schleifenförmige Struktur an der Oberfläche der Faser. Während des Alterungsprozesses geht sie von einer flexiblen, teils offenen, teils geschlossenen Form in einen vollständig geschlossenen Zustand über. Unsere Arbeit hat zudem gezeigt, dass diese Schleife wahrscheinlich als Altersmarkierung für Aktin-bindende Proteine dient: Indem Helferproteine an die Schleife binden, können sie das lokale Alter des Filaments erkennen und ihre Aufgaben zielgerichtet erfüllen. Beispiele hierfür sind Proteine wie Coronin, ein Helfer beim Umbau und der Vernetzung des wachsenden Aktinskeletts, oder Cofilin, welches beim Abbau von altem Aktin hilft.
Anti-Aging für Aktinfilamente
Aktinfilamente sind insbesondere durch ihre dynamische, sich ständig auf- und abbauende Struktur schwierig zu erforschen. Daher nutzen Forschende seit vielen Jahren natürliche stabilisierende Hilfsmittel. Zwei davon sind die Toxine Phalloidin und Jasplakinoid, die jeweils zu Selbstverteidigungszwecken vom grünen Knollenblätterpilz bzw. dem Meeresschwamm Jaspis splendens produziert werden. Beide Toxine verhindern den Abbau der Aktinfilamente und stabilisieren diese. Einfach ausgedrückt, wirken sie wie ein Superkleber, der die Fasern zusammenhält.
Doch obwohl der Kleber häufig in Zellversuchen genutzt wird, war seine genaue Funktionsweise bisher unklar. Mit systematischen Strukturuntersuchungen konnten wir nun aufklären, dass beide Toxine den Alterungsprozess des Aktinfilaments stoppen und teilweise sogar umkehren können. Aus unserer vorherigen Arbeit wissen wir, dass das Alter des Aktins entscheidend dafür ist, welche Helferproteine es bindet. Daher beeinflussen die Toxine neben der Stabilität des Filaments indirekt auch dessen Regulation und Funktion in der Zelle. Der Einsatz der Toxine in Zellexperimenten ist daher nicht nebenwirkungsfrei und sollte immer kritisch hinterfragt werden.
Schaltbarer Superkleber könnte Krebszellen töten
Die Toxine sind äußerst effektiv: Sie verkleben das Zellskelett und stören so die Bewegungs- und Teilungsfähigkeit von Zellen. Da diese zwei Eigenschaften besonders wichtig für das Überleben und die Verbreitung von Tumorzellen sind, könnten die Toxine Ausgangspunkte für neue Therapien in der Krebsmedizin sein. Allerdings können Aktin-bindende Toxine, wie die meisten Chemotherapeutika, nicht zwischen gesunden und kranken Zellen unterscheiden. Im Falle des Jasplakinolids gelang es uns in Kooperation mit unserem ehemaligen Kollegen Prof. Hans-Dieter Arndt (Universität Jena), eine Grundlage für den gezielten Einsatz zu schaffen. Hierfür hat er einen durch Licht kontrollierbaren Schalter in das Toxin eingebaut. Mithilfe der Kryo-EM konnten wir zeigen, wie sich durch Lichteinstrahlung eine Art chemisches Scharnier im Toxin öffnen lässt, das die stabilisierende Wirkung des gesamten Toxins beeinflusst. Diese Erkenntnisse dienen nun als Ausgangspunkt für die Weiterentwicklung schaltbarer Aktin-Stabilisatoren, die quasi auf Knopfdruck das Zellskelett verkleben. Der Weg zu einer möglichen Anwendung in der Medizin ist zwar noch weit, der schaltbare Aktin-Stabilisator könnte aber schon bald in Zellexperimenten genutzt werden.
