Eine Tasche voller Wassermoleküle
Dortmunder Max-Planck-Forscher enthüllen die kleinsten Details der Aktinfilamente
Aktinfilamente sind Proteinfasern, die das innere Skelett einer Zelle bilden. Als aktive Elemente unserer Zellen unterstützen sie die Zellfusion, die Zellbewegung und sind an vielen weiteren zellulären Prozessen beteiligt. Sie sind auch ein wichtiger Hauptbestandteil von Muskelzellen. Die strukturelle Komplexität dieser Filamente hat Forschende seit der Entdeckung von Aktin in den 1940er Jahren fasziniert und zu einer Flut unbeantworteter Fragen bezüglich der zellulären Funktion der Filamente geführt. Forschenden des Max-Planck-Instituts für molekulare Physiologie in Dortmund ist es nun erstmals gelungen, Hunderte von Wassermolekülen im Aktinfilament sichtbar zu machen – ein Quantensprung in der Aktinforschung. Mit Hilfe der Kryo-Elektronenmikroskopie (Kryo-EM) zeigt die Gruppe von Stefan Raunser in noch nie dagewesenem Detail, wie Aktin-Proteine in einem Filament angeordnet sind, wie ATP - die Energiequelle der Zelle - in der Proteintasche sitzt und wo sich einzelne Wassermoleküle positionieren und mit ATP reagieren.
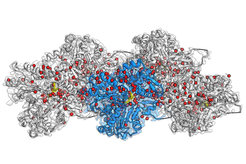
"Wir beantworten grundlegende Fragen des Lebens, die Forschende seit mehreren Jahrzehnten zu beantworten versuchen", sagt Raunser. In eukaryotischen Zellen sind Aktin-Proteine im Überfluss vorhanden und schließen sich zu Filamenten zusammen. Ein Netzwerk dieser Filamente bildet das Zytoskelett der Zelle, das verschiedene Zellprozesse durch Bewegung steuert. So nutzen z. B. Immunzellen Aktinfilamente, um sich zu bewegen und Bakterien und Viren zu jagen. Bekannt war bisher, dass die Dynamik der Filamente durch ATP-Hydrolyse reguliert wird - die Reaktion von ATP mit Wasser, bei der eine Phosphatgruppe gespalten wird und Energie entsteht. Die molekularen Details hinter diesem Prozess blieben bisher jedoch ungeklärt.
Zu flexibel, zu groß? – nicht für Kryo-EM
Da Aktinfilamente zu flexibel oder zu groß für Röntgenkristallisation und Kernspinresonanz sind, kann man detaillierte Bilder der Filamente nur mit der Kryo-EM erhalten. Im Jahr 2015 nutzte Raunsers Team bereits diese Technik, um ein neuartiges dreidimensionales atomares Modell der Filamente mit einer Auflösung von 0,37 Nanometern zu erstellen. Im Jahr 2018 beschrieb seine Gruppe die drei verschiedenen Zustände, die das Aktinprotein im Filament annimmt: gebunden an ATP, gebunden an ADP in Gegenwart des gespaltenen Phosphats und gebunden an ADP nach Freisetzung des Phosphats.
Wie sich Wassermoleküle bewegen
In ihrer jetzigen Studie konnte das Team um Stefan Raunser einen neuen Auflösungs-Rekord aufstellen: Sie erhielten Strukturen aller drei Aktin-Zustände mit einer Auflösung von ca. 0,2 Nanometern und konnten so zuvor unsichtbare Details sichtbar machen. Die dreidimensionalen Karten zeigen nicht nur alle Aminosäureseitenketten der Proteine, sondern verraten auch, wo sich Hunderte von Wassermolekülen befinden. Durch den Vergleich dieser neuen Strukturen mit denen von isoliertem Aktinprotein konnten sie folgern, wie sich die Wassermoleküle bewegen. Bei der Polymerisation verlagern sich die Wassermoleküle in der ATP-Tasche so, dass nur ein einziges Wassermolekül vor dem ATP verbleibt, bereit, ein Phosphat anzugreifen und die Hydrolyse einzuleiten. Die durch diesen Ansatz erzielten präzisen Einblicke haben das Potential, die weitere Forschung auf diesem Gebiet voranzutreiben: "Unser hochauflösendes Modell kann Forschenden bei der Entwicklung kleiner Moleküle für die lichtmikroskopische Forschung an Geweben und letztlich für therapeutische Anwendungen unterstützen", sagt Raunser.
2.2 Å Structur von F-actin gebunden an ADP-BeF3. (ATP-nachahmender Zustand).
Ein Türöffner!?
Die Autoren beleuchteten auch das Schicksal des Phosphats. Bisher glaubten die Forschenden, dass es in der ATP-Tasche eine Hintertür gibt, die nach der ATP-Hydrolyse geöffnet bleibt, um den Austritt des Phosphats zu erleichtern. Die neuen Kryo-EM-Strukturen zeigen jedoch keine offene Hintertür. Daher bleibt der Mechanismus der Phosphat-Freisetzung ein Rätsel. "Wir glauben, dass es in der Tat eine Tür gibt. Diese öffnet sich aber wahrscheinlich nur kurzzeitig und schließt dann wieder", kommentiert Raunser, der nun mathematische Simulationen und zeitaufgelöste Kryo-EM-Methoden einsetzen will, um zu zeigen, wie das Phosphat austritt. Diese aufregenden Entdeckungen haben den Forschenden offensichtlich die Tür geöffnet, noch mehr Details der Prozesse zu entdecken, mit denen Aktinfilamente zur Bewegung der Zelle beitragen.
