Von Krankheitserregern lernen
Forschungsbericht (importiert) 2011 - Max-Planck-Institut für molekulare Physiologie
Einleitung
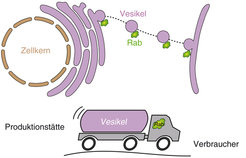
Ähnlich wie eine Großstadt ist die menschliche Zelle auf eine gut funktionierende und fein abgestimmte Infrastruktur angewiesen. Zur Aufrechterhaltung des Lebens auf der Ebene der menschlichen Zelle ist der Transport von Material von grundsätzlicher Bedeutung: Produktionslinien müssen aufeinander abgestimmt, Botenstoffe müssen an die Umgebung abgegeben und Krankheitserreger müssen aufgenommen und ihrer Zerstörung zugeführt werden. Die Basis all dieser Transportprozesse ist die Verpackung des Transportmaterials in Vesikel, die, um bei der Analogie mit einer Stadt zu bleiben, in ihrer Funktion LKWs gleichen. Die zeitliche und räumliche Koordination dieser lastwagenähnlichen Vesikel und ihrer Verkehrswege ist wichtig für so unterschiedliche Prozesse wie die kontrollierte Muskelkontraktion oder die Zerstörung von Krankheitserregern. Eine Klasse kleiner Proteine kümmert sich daher intensiv um die Regulation der vesikelvermittelten Transportprozesse und stimmt damit einzelne Verschickungsvorgänge aufeinander ab. Diese Proteine wurden erstmals im Rattenhirn (engl.: rat brain) identifiziert und daher als Rab-Proteine bezeichnet [1]. Rab-Proteine fungieren als molekulare Schalter, die in zwei Aktivitätszuständen vorliegen können. Im aktiven Zustand stimulieren sie vesikelvermittelte Transportvorgänge, z.B. das Auslösen der Muskelkontraktion, wohingegen sie im inaktiven Zustand auf ihre eigene Stimulation durch andere Proteine warten. Wenn Vesikel also analog zu Lastwagen sind, entsprechen die Rab-Proteine den LKW-Fahrern (Abb. 1).
Rab-Proteine regulieren Transportvorgänge
Die Familie der Rab-Proteine umfasst etwa 60 unterschiedliche Mitglieder. Auch wenn Forscher die molekularen Wirkungen der „Rabs“ seit ihrer Entdeckung vor ca. 30 Jahren immer besser verstehen [1], so sind wir doch noch weit davon entfernt, die Eigenschaften und zellulären Bedeutungen jedes individuellen Mitgliedes im Detail zu kennen. Leider ist die molekulare Analyse einzelner Proteine sehr aufwändig und die Ergebnisse können sich außerdem von Zelltyp zu Zelltyp deutlich unterscheiden: Beispielsweise haben Magenwandzellen, die hauptsächlich Material in Form von Verdauungsenzymen abgeben, im Detail ganz andere Ansprüche an vesikuläre Transportvorgänge als Immunzellen, die vor allem Material in Form von potenziellen Krankheitserregern aufnehmen und der Zerstörung zuführen. Erstaunlicherweise geben eben jene Krankheitserreger den Forschern hin und wieder Werkzeuge in die Hand, mithilfe derer sie ein tieferes Verständnis für vesikelvermittelte Transportvorgänge bekommen können.
Legionellen manipulieren Immunzellen
Das Bakterium Legionella pneumophila ist ein solcher Krankheitserreger, der in der Vergangenheit wertvolle Einblicke in humane zelleigene Transportvorgänge ermöglicht hat [2]. Legionellen können die bekannte Legionärskrankheit auslösen, wenn sie in Form von Aerosolen in die Lunge eingeatmet werden. In der Lunge werden sie von Immunzellen erkannt, die diese Bakterien aufnehmen und im Weiteren der Zerstörung zuführen möchten. Die Legionellen lassen sich zwar passiv aufnehmen, haben aber Mittel und Wege gefunden, der anschließenden Vernichtung zu entgehen. Die bakteriellen Mechanismen dieser Resistenz sind vielfältig und werden durch ca. 300 unterschiedliche Proteinfaktoren vermittelt, die von dem Bakterium ins Innere der Wirtszelle freigesetzt werden. Ein Teil der freigesetzten Proteine übernimmt dabei die Kontrolle über eine Klasse von Rab-Proteinen und verwendet molekulare Mechanismen, die zum Verständnis der Funktionsweise von Rabs beigetragen haben. Insbesondere das Legionellenprotein DrrA hat das Interesse der Forscher geweckt.
Das Legionellenprotein DrrA manipuliert Rab-Proteine
DrrA hat zwei erstaunliche Eigenschaften: Zunächst ist es ein äußerst wirkungsvoller Kidnapper des Rab-Proteins Rab1, das normalerweise die allerersten Schritte von Produktionsprozessen in der Zelle steuert [3, 4]. Legionellen nutzen Rab1, um ihre Präsenz in der Immunzelle zu tarnen und der destruktiven Entdeckung entkommen zu können. Damit verhindern die Legionellen, dass die Verteidigungssysteme der Immunzelle ihr zerstörerisches Arsenal einsetzen können.
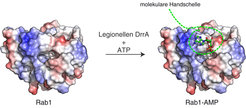
Allerdings müssen die Legionellen gleichzeitig verhindern, dass Rab1 als einer der Aufpasser des vesikulären Transportes von den normalen Recyclingprozessen der Zelle erfasst wird und wieder verschwindet. Zu diesem Zweck besitzt DrrA eine zweite hochinteressante Aktivität, die es den Legionellen ermöglicht, Rab1 dauerhaft zu kontrollieren: Es gelingt DrrA nämlich, Rab1 Handschellen anzulegen (Abb. 2) [5, 6]. Selbstverständlich sind diese Handschellen nur von molekularer Größe und das Rab1 wird damit mehr verklebt als wirklich gefesselt. DrrA bedient sich eines kleinen Moleküls, des Adenosintriphosphats (ATP), das es an eine regulatorisch bedeutsame Position von Rab1 hängt und damit Rab1 für andere, recycelnde Proteine unsichtbar macht. ATP ist die allgemeine Energiewährung unserer Zellen und daher in großem Umfang vorhanden.
Chemiker und Biochemiker bauen zusammen Werkzeuge für die Analyse von ATP-modifizierten Proteinen
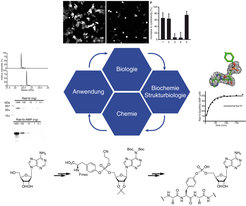
Die Aktivitätskontrolle von Rab1 durch die DrrA-vermittelte Modifikation mit ATP ist überraschend, da ein solcher Mechanismus bisher noch nie in der Regulation vesikulärer Transportprozesse beobachtet worden ist. Auch wenn diese Strategie in der hier geschilderten speziellen Situation von Legionellen verfolgt wird, so stellt sich die bedeutsame Frage, ob eine derartige Regulation nicht den Normalfall darstellen könnte und bis zum jetzigen Zeitpunkt lediglich noch nicht beobachtet worden ist. Aus diesem Grund wurden molekulare Sonden gebaut, mithilfe derer die Detektion der Modifikation mit ATP möglich wird [7]. Zu diesem Zweck wurde als erstes die Modifikation auf organisch-chemischem Wege synthetisiert und dann künstlich in Proteinfragmente eingeführt (Abb. 3). Die große Ausbeute sowie die hohe Reinheit und Homogenität dieses synthetischen Produktes ermöglichte es, auf biologischem Wege Immunsubstanzen – sogenannte Antikörper – herzustellen. Diese Antikörper sind selbst Proteine, die eine äußerst starke Bindung an ATP-modifizierte Proteine (wie z.B. Rab1) besitzen. Im Gegensatz zu der Modifikation alleine können die Antikörper biochemisch sehr einfach detektiert werden und dienen damit als molekulare Leuchttürme für die Anwesenheit ATP-modifizierter Proteine. Somit existiert nun ein Werkzeug, mit dessen Hilfe in jedem vorstellbaren Organismus nach bisher unbekannten ATP-modifizierten Proteinen gesucht werden kann. Auf diese Weise könnenzelluläre Prozesse entdeckt und entschlüsselt werden, die der Aufmerksamkeit der Forscher bis jetzt entgangen sind.
Schlussbemerkung
Die Analyse von Bakterien wie zum Beispiel von Legionellen ist nicht nur für die Infektionsbiologie interessant. Hier konnten Bakterien den Wissenschaftlern eine Reaktion zeigen, die sie bisher noch gar nicht gekannt hatten, nämlich die Modifikation von Rab-Proteinen mit ATP. Die Kombination von Biochemie und Organischer Chemie ermöglicht im Weiteren die Herstellung von molekularen Werkzeugen, mit deren Hilfe nun neue Fragestellungen angegangen werden können (Abb. 3). Auch in der Zukunft halten Krankheitserreger sicherlich noch einige unangenehme, aber auch interessante Neuigkeiten für die Wissenschaft bereit.


