Neue Proteine zur Aktivierung molekularer Schalter in Pflanzen
Forschungsbericht (importiert) 2006 - Max-Planck-Institut für molekulare Physiologie
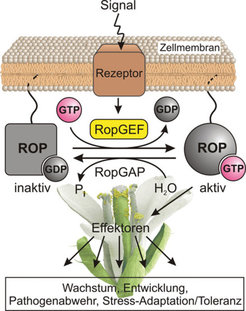
Das Leben einer Pflanze wird von sehr vielen unterschiedlichen Reizen aus ihrem Körperinneren sowie der Umgebung beeinflusst. Ein komplexes System zur Signalaufnahme registriert diese eigenen und fremden Signale und verarbeitet sie in biochemischen Reaktionsketten, die das ursprüngliche Signal kaskadenartig weiterleiten, hochgradig verstärken und schließlich ganz spezifische Reaktionen in einer Zelle auslösen. Als Kontrollpunkte dienen in vielen Signalwegen der Pflanze kleine GTP (Guanosintriphosphat)-bindende Eiweißmoleküle der Rho-Familie, die ROP-Proteine, die als molekulare Schalter die Signalübertragung vermitteln [1].
GTP-bindende Rho-Proteine als molekulare Schalter
Ähnliche Schalterproteine kennt man auch von Tieren und Pilzen. Diese Rho-Proteine sind eine Untergruppe der Ras-Superfamilie kleiner GTP-bindender Proteine (G-Proteine), die eine Vielzahl von physiologischen Prozessen beeinflussen [2]. Ihre Schalterfunktion beruht darauf, dass entweder das Nukleotid GDP (Guanosindiphosphat) oder GTP an sie gebunden ist. Im GDP-gebundenen Zustand sind die Proteine inaktiv. Im GTP-gebundenen, aktiven Zustand binden sie an Effektorproteine und leiten auf diese Weise die Signale weiter. Der Übergang zwischen dem inaktiven und dem aktiven Zustand wird durch regulatorische Proteine kontrolliert, die direkt und spezifisch mit den kleinen G-Proteinen wechselwirken. Guaninnukleotid-Austauschfaktoren (GEFs) bewirken als positive Regulatoren die Freisetzung von GDP, erleichtern dadurch die Bindung von GTP und aktivieren somit die G-Proteine. Die Spaltung von GTP zu GDP erfolgt durch die intrinsische GTPase-Aktivität der kleinen G-Proteine, bedarf jedoch einer Katalyse durch GTPase-aktivierende Proteine (GAPs), die somit als negative Regulatoren das Schalterprotein inaktivieren.
Vielfache Untersuchungen der letzten Jahre haben gezeigt, dass die pflanzlichen Rho-Proteine, die ROPs (Rho of plants), eine zentrale Rolle in zahlreichen physiologischen Prozessen spielen, indem sie das pflanzliche Wachstum und die Entwicklung beeinflussen, die Befruchtung steuern und die Reaktionen der Pflanze auf diverse Umwelt- und Stressfaktoren (z. B. Schädlingsbefall) kontrollieren [1]. Die dabei auf die Pflanze einwirkenden Signale werden häufig durch Rezeptorproteine an der Zelloberfläche wahrgenommen und in das Zellinnere übermittelt. Diese Signale können dort jedoch nur dann einen Effekt bewirken, wenn der molekulare Schalter durch GEF-Proteine betätigt, also aktiviert wird. Lange Zeit war jedoch völlig unklar, wie die ROP-Proteine aktiviert werden, da in Pflanzen die notwendigen Austauschfaktoren für ROPs nicht bekannt waren.
Neue Austauschfaktoren zur Aktivierung der ROP-Proteine in Pflanzen
Die Dortmunder Max-Planck-Forscher haben kürzlich das Rätsel der ROP-Aktivierung gelöst und eine neue Familie von Proteinen in Pflanzen identifiziert, die als ROP-spezifische Austauschfaktoren (RopGEFs) funktionieren [3].
Obwohl G-Proteine und ihre Regulatoren im Allgemeinen als konserviert gelten, das heißt homologe Proteine in Tieren, Pilzen und Pflanzen zu finden sind, weisen die pflanzlichen RopGEFs mit ihrer für GEF-Proteine ungewöhnlichen funktionellen Einheit, der katalytisch aktiven so genannten PRONE-Domäne, interessanterweise keinerlei Übereinstimmung mit Proteinen aus den anderen Reichen höherer Organismen auf. Ihnen gegenüber stehen die in ihrer Aminosäureabfolge völlig verschiedenen RhoGEFs der Tiere und Pilze, die wiederum keine Entsprechung im Pflanzenreich finden. Diese Tatsache lässt die Dortmunder Arbeitsgruppen um Alfred Wittinghofer und Antje Berken vermuten, dass sich die GEFs als Aktivatoren für die Rho-Familie kleiner GTPasen während der Evolution als „späte Erfindung“ erst nach der Trennung des Pflanzenreichs von Pilzen und Tieren entwickelt haben.
Bei weiteren Vergleichen dieser neuen RopGEFs mit Datenbankeinträgen stellten die Wissenschaftler fest, dass einige Vertreter dieser Proteinfamilie direkt an membranständige Rezeptorproteine binden, die die RopGEFs möglicherweise zur Zellmembran rekrutieren und in ihrer Funktion als Kinasen eventuell deren Aktivität über Phosphorylierungsreaktionen steuern. Die Forscher aus Dortmund schlagen für ROP-abhängige Prozesse in Pflanzen eine geschlossene Reaktionskette vor, in der eingehende Signale über solche Rezeptorproteine in der Zellmembran registriert und an RopGEFs weitergeleitet werden. Diese aktivieren ihrerseits das Schalterprotein ROP und setzen auf diese Weise über Effektormoleküle multiple Signalketten in Gang, und zwar so lange, bis die RopGAPs den Schalter in den inaktiven Zustand zurückversetzen (Abb. 1).
Struktur-Funktionsbeziehungen bei der RopGEF-Katalyse
Im weiteren Verlauf der Arbeiten mit den neuen RopGEFs der Pflanzen ist es dem Dortmunder Team aus Biologen, Biochemikern und Kristallographen vor kurzem ebenfalls gelungen, die katalytisch aktive PRONE-Domäne eines RopGEFs (RopGEF8) aus Arabidopsis thaliana sowohl allein als auch im Proteinkomplex mit einem ROP-Protein (ROP4) zu kristallisieren und die dreidimensionalen Strukturen röntgenkristallographisch zu bestimmen [4, 5].
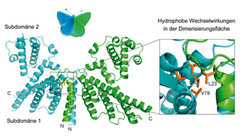
Dabei zeigte sich, dass die RopGEF-Domäne (PRONE8) eine völlig neuartige Raumstruktur aus zwei Subdomänen einnimmt und über Wechselwirkungen zwischen hydrophoben Aminosäuren im Bereich der Helices α1 und der darauf folgenden Schleifenstrukturen ein schmetterlingsförmiges Dimer aus zwei Molekülen bildet (Abb. 2). Die funktionelle Bedeutung dieses Dimers konnten die Wissenschaftler durch biochemische Charakterisierung von mutierten PRONE8-Proteinen mit Aminosäureaustauschen in der Dimer-Kontaktfläche nachweisen. Die Ausbildung eines katalytisch aktiven Dimers ist eine Besonderheit der pflanzlichen RopGEFs. Alle bekannten, strukturell jedoch völlig verschiedenen GEF-Domänen aus Tieren oder Pilzen funktionieren dagegen als Monomere.
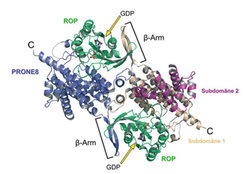
Weitere entscheidende Einblicke in die Funktion der pflanzlichen RopGEFs erhielten die Forscher bei der Analyse der Struktur des Proteinkomplexes aus PRONE8 und ROP4 (Abb. 3). Im Komplex bindet das PRONE8-Dimer zwei ROP4-Moleküle. Dabei fällt in der fast ausschließlich aus α-Helices bestehenden PRONE-Domäne ein Element aus β-Strängen auf, das in der unkomplexierten Struktur zuvor nicht sichtbar war. Dieser so genannte β-Arm einer PRONE8-Untereinheit umschließt jeweils ein auf der gegenüberliegenden Seite von der zweiten PRONE8-Untereinheit gebundenes ROP-Molekül. Eine derartige strukturelle Anordnung erklärt, warum eine Dimerisierung für die RopGEF-Aktivität unerlässlich ist. Eine weitere Besonderheit in dieser Struktur ist die Anwesenheit des Nukleotids GDP im ROP-Protein, was bislang noch nie direkt in Komplexen aus kleinen G-Proteinen und GEF-Domänen beobachtet werden konnte. Stabile G-Protein-GEF-Komplexe bilden sich im Allgemeinen erst nach Freisetzung des Nukleotids aus. Das Forscherteam aus Dortmund nimmt daher an, dass der erfasste GDP-enthaltende Proteinkomplex einen kurzlebigen Übergangszustand im Reaktionsmechanismus der GEF-Katalyse darstellt.
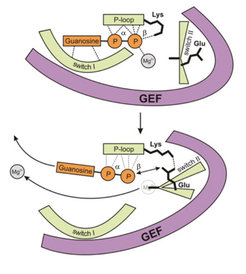
Die weitere Analyse der Struktur dieses Übergangszustands ermöglichte den Wissenschaftlern am MPI für molekulare Physiologie, wichtige mechanistische Einzelheiten der GEF-vermittelten Nukleotidfreisetzung näher aufzuklären. Dabei wurde deutlich, dass die Interaktion mit der GEF-Domäne strukturelle Veränderungen in hoch konservierten Regionen des ROP-Proteins induziert, die die Wechselwirkungen zwischen G-Protein und Nukleotid schwächen (Abb. 4). Im späteren Verlauf der Katalyse bewirken die weiter fortgeschrittenen Umlagerungen im G-Protein dann offenbar die endgültige Freisetzung des Nukleotids.
Da vergleichbare Restrukturierungen auch in nukleotidfreien Proteinkomplexen zwischen kleinen G-Proteinen aus Tieren und deren strukturell jedoch andersartigen GEFs beobachtet wurden, vermuten die Forscher des Max-Planck-Instituts, dass der beobachtete Übergangszustand bei allen GEF-katalysierten Reaktionen kleiner G-Proteine auftritt und der Nukleotidaustausch nach einem allgemein gültigen Reaktionsmechanismus abläuft.