Nach 30 Jahren weitgehend aufgeklärt: Die molekularen Grundlagen des Zuckertransportes in Darm und Niere
Forschungsbericht (importiert) 2004 - Max-Planck-Institut für molekulare Physiologie
Im Andenken an meine Frau und wissenschaftliche Weggefährtin Prof. Dr. Evamaria Kinne-Saffran
Zucker ist ein wesentlicher Energieträger, der für die verschiedensten Funktionen des Körpers wie Bewegung und Denken essentiell ist. Er wird im Dünndarm aus der Nahrung ins Blut aufgenommen und von dort an die Organe wie Muskel und Gehirn verteilt. In der Niere wird er im Rahmen der Reinigung des Blutes von Fremdstoffen in den Primärharn filtriert und aus diesem als wertvoller Brennstoff wieder zurückgewonnen. Die Konzentration von Glucose, dem hauptsächlich vom Körper benötigten Zucker, wird im Blut durch eine Reihe komplexer Mechanismen auf einem konstanten Wert gehalten. Abweichungen nach unten (Hypoglykämie) wie auch nach oben (Diabetes) stellen akute oder chronische Erkrankungen dar. Besonders der Diabetes hat in letzter Zeit große medizinische und wirtschaftliche Bedeutung gewonnen.
Daher ist die Aufklärung der Mechanismen der Zuckeraufnahme nicht nur von grundlegender biologischer Bedeutung, sondern bietet auch neue Ansätze für mögliche Behandlungen dieser Volkskrankheit.
Sowohl Darm als auch Niere sind von Zelllagen, so genannten Epithelien, ausgekleidet. Ihre Funktion ist es zum einen, eine Barriere gegen schädliche Einwirkungen von außen zu bilden, zum anderen, vom Körper benötigte Stoffe gezielt aufzunehmen und toxische Stoffe gezielt auszuscheiden. Die Epithelzellen sind es auch, die die Aufnahme von Substanzen wie Zuckern in den Körper bewerkstelligen.
Die biophysikalischen Grundlagen für den transepithelialen Transport
Um die gezielte und gerichtete Aufnahme von Substanzen in den Körper bewerkstelligen zu können, müssen verschiedene biophysikalische Prinzipien verwirklicht werden. Das erste Prinzip ist das der Asymmetrie. Dies bedeutet, dass bei einem Transport durch die Zelle, wie er mit der Glucose geschieht, die Aufnahme in die Zelle und die Abgabe aus der Zelle in das Blut durch unterschiedliche Mechanismen erfolgen muss, ansonsten würde ein Transport in nur eine Richtung nicht zustande kommen.
Die Aufnahme in die Zelle erfolgt an der Zellseite, die dem Darm- (oder Nierentubulus-) Lumen zugewandt ist, dem luminalen oder apikalen Zellpol, während die Abgabe ins Blut am basolateralen Zellpol erfolgt. Auch hier ist ein gerichteter Transport nötig. Dieser wird durch Proteine in der die Zelle umgebenden Zellmembran vermittelt, die sich ebenfalls durch Asymmetrie auszeichnen müssen. Diese Transportproteine verleihen den Transportvorgängen außerdem die gewünschte Spezifität, das heißt es werden nur ganz bestimmte Substanzen aufgenommen - wie im Falle der Zucker nur D-Glucose, aber nicht das Stereoisomer L-Glucose.
Das Nieren- und Darmepithel kann Zucker aus dem entsprechenden Lumen auch dann noch ins Blut transportieren, wenn die intraluminale Konzentration sehr viel niedriger als die Konzentration im Blut ist, d.h. es kann aktiven Transport durchführen. Daraus leitet sich das zweite biophysikalische Prinzip ab, nämlich, dass mindestens an einem der Transportschritte durch die Membran Energie zugeführt werden muss [1].
Die Grundlagen der zellulären Asymmetrie
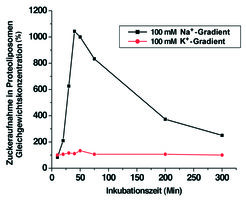
Zur Aufklärung der für die Gesamtzelle erhobenen biophysikalischen Hypothesen waren neue Ansätze insbesondere biochemischer Natur notwendig. Durch die trägerfreie Elektrophorese – eine aufwändige, jedoch effiziente Methode, die ursprünglich am Max-Planck-Institut für Biochemie in München entwickelt wurde – gelang es 1971 erstmalig, die den luminalen und kontraluminalen Zellpol bedeckenden Zellmembranen zu trennen sowie biochemisch und funktionell zu charakterisieren [2].
Mithilfe dieser Membranpräparationen konnte auch die Art der Energie, die für den Transport benötigt wird, identifiziert werden. Es ist dies der Gradient von Natrium über die Zellmembran. Ionengradienten-getriebene Transportsysteme sind in der Zwischenzeit in allen tierischen Zellen, bei Bakterien und bei Pflanzen nachgewiesen worden – sie stellen neben den unter ATP-Verbrauch aktiven Transportsystemen die zweite wesentliche Gruppe von (sekundär) aktiven Transportproteinen dar (Abb. 1), [3].
Modell des transepithelialen Zuckertransportes in Darm und Niere
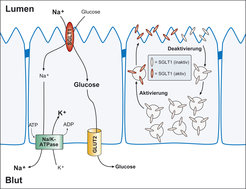
Auf den genannten Befunden beruht das auch heute noch gültige Modell des transepithelialen Zuckertransportes in Darm und Niere (Abb. 2). Wesentliche Elemente sind dabei das Natrium-D-Glucose-Kotransportsystem (SGLT), das Natrium-unabhängige Zuckertransportsystem (GLUT) und die Na+-K+-ATPase.
Letzteres Transportsystem generiert aktiv eine im Vergleich zum Blut sehr viel niedrigere Konzentration von Natrium in den Zellen, dieser Natrium-Gradient wirkt dann als treibende Kraft für das Natrium-D-Glucose-Kotransportsystem und bewirkt eine sekundär aktive Akkumulation von D-Glucose in der Zelle. Der Zucker verlässt die Zelle dann am kontraluminalen Zellpol in das Blut; dieser Vorgang benötigt keine Energie.
Neue Befunde zeigen, dass die Menge an SGLT-Transportproteinen in der luminalen Membran je nach Bedarf reguliert werden kann und zusätzlich noch eine Aktivierung und Inaktivierung der Transportproteine möglich ist – beide Prozesse dienen der Anpassung der Transportleistung der Zelle an die Bedürfnisse des Körpers. Abbildung 2 ist um diese Abläufe erweitert worden.
Die molekularen Eigenschaften des Transportproteins SGLT
1987 wurden mit der Klonierung der Gene für die Transportproteine SGLT und GLUT deren Aminosäuresequenzen bekannt, und die cDNA konnte für weitere Experimente eingesetzt werden. Die Daten erbrachten wesentliche Erkenntnisse über die Proteinstrukturen.
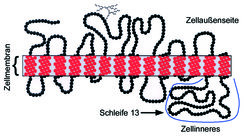
Zunächst konnte für SGLT die Sekundärstruktur und die Anordnung der Aminosäurekette in der Membran auf Grund von Computermodellen vorhergesagt werden. Als Grundelemente der Sekundärstruktur sind dabei Helices und etwas weniger geordnete Bereiche des Proteins, die Schleifen, erkannt worden. Die Helices können, wenn sie etwa 24 Aminosäuren enthalten, durch die Phospholipid-Doppelschicht der Zellmembran hindurchreichen – als so genannte transmembrane Helices. Ihre Abfolge bestimmt dann die Topologie des Transportproteins in der Membran (Abb. 3). Ebenso gut zu erkennen ist die sich daraus ergebende biophysikalisch geforderte Asymmetrie des Proteins, die sich auch in unterschiedlichen funktionellen Eigenschaften der dem Zellinneren und der Zellaußenseite zugekehrten Abschnitte des Transportproteins äußert [6].
Die Kenntnis der cDNA und die entsprechenden molekularbiologischen Methoden ermöglichten es, die für die Funktion des Proteins wesentlichen Bereiche durch gezielte Veränderung von Aminosäuren zu identifizieren, Antikörper zu erzeugen, die nur mit bestimmten Bereichen des Transportproteins reagieren, gezielt Reportergruppen in das Protein einzubauen und es für die Expression in Fremdorganismen zu modifizieren. Dadurch werden diese Proteine, die normalerweise nur in sehr geringen Mengen vorkommen, wieder für biochemische und biophysikalische Untersuchungen zugänglich.
Eine solche Expression des menschlichen SGLT ist kürzlich in einem Hefestamm gelungen. In Fluoreszenzmessungen konnten zum ersten Mal auf Grund von funktionellen Daten postulierte verschiedene Zustände des Transportproteins nachgewiesen werden; sie stellen die Teilschritte der Translokation von Zuckern durch die Membran dar.
Diese im Reagenzglas erarbeiteten Befunde wurden jedoch unter sehr künstlichen Bedingungen erhalten, deswegen ergibt sich immer wieder die Frage nach der Relevanz für die Funktion des Transportsystems in seiner natürlichen Umgebung, der Zellmembran und der lebenden Zelle.
Einzelmolekül-Kraftmikroskopie an SGLT
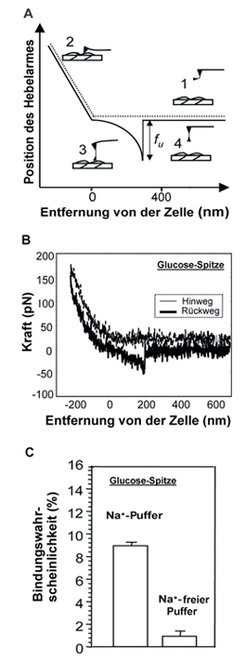
Untersuchungen in der natürlichen Umgebung des Proteins sind kürzlich durch die Einzelmolekül-Kraftmikroskopie möglich geworden. Das SGLT-Proteinmolekül mit einem Radius von etwa 300 x 10-9 m kann auf der Zellmembran durch die Wechselwirkung mit einem Antikörper oder sogar mit der transportierten Substanz D-Glucose entdeckt werden. Dabei wird ein mit einem einzigen Molekül bestückter Federbalken mit atomarer Spitze über die Zelloberfläche geführt und durch die Wechselwirkung mit dem Protein abgelenkt. Diese Ablenkung wird optisch erfasst und vergrößert, sodass winzige Ablenkungen eindeutig registriert werden und die Anwesenheit der Transportproteine indirekt nachgewiesen werden kann (Abb. 4), [7].
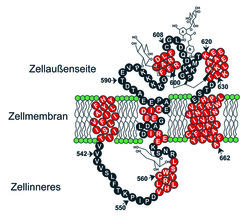
Neue Topologie des Transportproteins SGLT
Unter Berücksichtigung der bisher mit den verschiedensten Methoden erhaltenen Ergebnisse können die Wissenschaftler um Rolf Kinne daher ein modifiziertes Modell für die Topologie des Transportproteins besonders im Bereich der Schleife 13 vorschlagen. Bei dem in Abbildung 5 gezeigten Modell ist die Schleife 13 jetzt dem Zelläußeren zugewandt, wo der Transporter, wie hier dargestellt, mit Hemmstoffen (Phlorizin) reagieren kann [8, 9]. Die Schleife besitzt aber auch Natrium- und D-Glucosebindungsstellen, die in der Erkennung der beiden Substrate eine Rolle spielen. Ein weiterer, dem Zellinneren zugekehrter Teil enthält ebenfalls eine Zuckerbindungsstelle. Für den Transport durch die Membran kann jetzt ein neues mehrstufiges Modell formuliert werden, das die besondere Rolle der Schleife 13 bei den ersten Schritten des Transports hervorhebt [10].
Diese Region ist auch der Bereich, in dem Hemmstoffe des Transportes angreifen und damit eine mögliche Zielregion für Medikamente, die die Zuckeraufnahme in den Körper hemmen und damit den Blutzuckerspiegel senken könnten.
Zum Verständnis des Gesamtvorgangs fehlen jedoch noch zwei Elemente. Zum einen ist der weitere Weg der Glucose durch das Protein unbekannt – dazu werden zurzeit in Kooperation mit einer amerikanischen Gruppe Versuche durchgeführt. Zum anderen ist die energetische Kopplung zwischen dem Natriumgradienten und der Zuckertranslokation noch ungeklärt. Die jetzt geschaffenen Möglichkeiten erlauben erste Kristallisationsversuche des Natrium-Glukose-Kotransporters, dessen röntgenkristallografische Analyse zur Klärung von Struktur und Funktion beitragen wird.
Der transdisziplinäre Ansatz als Grundlage des Erfolges
Die geschilderten Untersuchungen zeigen, wie die verschiedenen Gebiete der Lebenswissenschaften – Biophysik, Biochemie, Molekularbiologie und Zellbiologie – zu unterschiedlichen Zeitpunkten der Untersuchungen ihre wesentlichen Beiträge haben leisten können. Diese Möglichkeit der schnellen Adaptation der Methoden und Konzepte an den neuesten Stand der Entwicklung ist ein wesentliches Merkmal der Forschung in der Max-Planck-Gesellschaft.
"Aus Anlass meiner Emeritierung im September 2005 möchte ich der Max-Planck-Gesellschaft für die langjährige Unterstützung meiner Forschung danken, ebenso danke ich allen Mitarbeiterinnen und Mitarbeitern für ihren tatkräftigen, engagierten und kompetenten Einsatz für die Wissenschaft."
Rolf K. H. Kinne




