Strukturelle und mechanistische Aspekte der Regulation des intrazellulären vesikulären Transports
Forschungsbericht (importiert) 2003 - Max-Planck-Institut für molekulare Physiologie
Der Transport von Makromolekülen, insbesondere von Proteinen, innerhalb der Zelle ist ein lebenswichtiges Merkmal der eukaryontischen Zelle. Ein essentieller Mechanismus für solche Vorgänge ist der vesikuläre Transport. Das Grundprinzip umfasst die folgenden Schritte: An einer Donororganelle bilden sich zunächst membranumschlossene Transportvesikel, die sich abschnüren und zu einer Zielmembran transportiert werden. Nach Erkennung verschmelzen sie mit dieser Membran und ihr Inhalt wird freigesetzt, zum Beispiel in das Lumen der Zielorganelle. An diesen komplexen Vorgängen sind zahlreiche Protein-Protein-Wechselwirkungen beteiligt, die zurzeit weltweit Gegenstand intensiver Untersuchungen sind. Die Forscher der Abteilung Physikalische Biochemie am Dortmunder MPI interessieren sich für die Regulation dieser Vorgänge durch die so genannten Rab-Proteine (Rab = Ras-like protein from rat brain). Diese Proteine stellen die größte Gruppe der Superfamilie der kleinen GTPasen (Ras-Superfamilie) dar und sind an allen Teilabschnitten des Transportmechanismus beteiligt.
Es besteht eine starke strukturelle und mechanistische Verwandtschaft zwischen den Ras-ähnlichen Proteinen und die gemeinsamen Grundlagen ihrer Wirkmechanismen sind in den letzten zwei Jahrzehnten weitgehend aufgeklärt worden. So existieren Proteine der Ras- Superfamilie in zwei verschiedenen Formen, die man als aktiv oder inaktiv bezeichnet, wobei in der aktiven Form GTP (Guanosintriphosphat) und in der inaktiven Form GDP (Guanosindiphosphat) am aktiven Zentrum gebunden ist. Der Übergang zwischen diesen Formen wird einerseits durch Hydrolyse von GTP zu GDP, andererseits durch Austausch von GDP gegen GTP bewerkstelligt. Diese Vorgänge, die für die meisten Mitglieder der Superfamilie in der isolierten Form sehr langsam sind, werden erheblich durch Einwirkung zusätzlicher Faktoren beschleunigt. Hier handelt es sich bei der GTPase-Reaktion um so genannte GAPs (GTPase activating proteins) sowie beim GDP/GTP-Austausch um GEFs (guanine nucleotide exchange factors). Die entscheidende Eigenschaft der aktiven (GTP) Form der Proteine ist ihre Fähigkeit, mit weiteren Proteinmolekülen einer Signaltransduktions- oder Regulationskette in Wechselwirkung zu treten, was in der inaktiven (GDP) Form nicht möglich ist. Solche Proteine werden Effektoren genannt.
Eine weitere essentielle Eigenschaft der meisten Ras-ähnlichen Proteine ist die Verankerung in spezifischen Membranen, die über Lipidreste bewerkstelligt wird. Bei der Rab-Familie, die im Menschen über 60 Vertreter einschließt, handelt es sich dabei um zwei Geranylgeranylreste (in wenigen Fällen einen Rest) an C-terminalen Cysteinen. Diese Prenylgruppen (das heißt Farnesyl- oder Geranylgeranylgruppen) erlauben die reversible Assoziation der Rab-Proteine mit Membranen, ein charakteristisches Merkmal ihrer Wirkungsweise. Prenylgruppen werden auf Proteine durch eins von drei verschiedenen Enzymen übertragen. Beispielsweise wird Ras durch Farnesyltransferase farnesyliert, während ein anderes Mitglied der Ras-Superfamilie, Rho, durch GGTase I (Geranylgeranyltransferase) geranylgeranyliert wird. Beide Transferasen erkennen ein CAAX-Motif am C-Terminus der Substratproteine, wobei die Spezifität durch den X-Rest bestimmt wird. Im Gegensatz dazu zeigt das dritte Mitglied der Proteinprenyltransferasen, RabGGTase oder GGTase II, keine ausgeprägte Sequenzspezifität, sondern benötigt einen zusätzlichen Proteinfaktor, das so genannte Rab-Escort-Protein (REP) für Rab-Prenylierungsaktivität. So erkennt RabGGTase nicht ein Rab-Molekül, sondern einen Komplex zwischen REP und Rab.
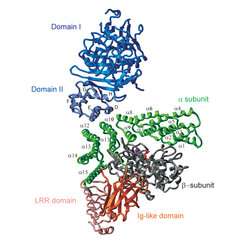
Die Prenylierung von Rab-Proteinen findet in einem ternären Komplex (Rab:Rep:GGTase) statt, der nach ausführlichen biophysikalischen Untersuchungen als 1:1:1 Komplex hergestellt und gereinigt werden kann. Dieser Komplex wurde kristallisiert, allerdings reicht die Qualität der Kristalle nicht aus für die Bestimmung der 3-dimensionalen Struktur durch Kristallographie mit Röntgenstrahlen. Im Gegensatz dazu konnte die Struktur eines Komplexes zwischen REP-1 und RabGGTase durch Proteinkristallographie bestimmt werden (Abb. 1). Die Bindungstelle für REP-1 an der RabGGTase befindet sich nicht, wie in früheren Arbeiten nach Modellvorstellungen anderer Gruppen angenommen wurde, in der LRR (leucine rich repeat) oder Ig-ähnlichen Domäne, sondern in der alpha-Untereinheit der GGTase auf der gegenüberliegenden Seite des Moleküls. Ein Vergleich der REP-Struktur mit der schon bekannten Struktur von Rab-GDI (GDI = GDP-Dissoziationsinhibitor), der für die Herauslösung von Rab-Molekülen aus der Membran verantwortlich ist, zeigte eine große strukturelle Ähnlichkeit, erlaubte aber über Analyse der Unterschiede die Aufklärung des Mechanismus der Unterscheidung der RabGGTase zwischen REP und GDI-Molekülen.
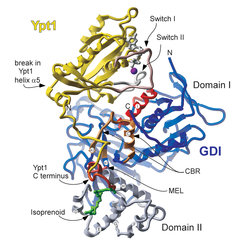
Im weiteren Verlauf der Arbeiten konnte die Struktur eines Komplexes zwischen einem geranylgeranylierten Rab-Molekül aus Hefe (Ypt1) und GDI bestimmt werden (Abb. 2). Die Herstellung dieses Komplexes war nur durch eine Kombination von molekularbiologischen Methoden und chemischer Synthese des prenylierten C-Terminus von Ypt1 möglich. Der Ort der Wechselwirkung der GTPase-Domäne von Ypt1 mit GDI stimmte mit Voraussagen aus Mutationsstudien überein. Allerdings binden der C-Terminus und der Prenylrest nicht in der erwarteten Region, sondern in der unteren Domäne (Domäne II) von GDI. Diese Bindungsstelle ist in der Struktur des GDI-Moleküls ohne Rab nicht identifizierbar, da der "Bindungstunnel" durch mehrere alpha-Helices blockiert ist. Das gewonnene Modell zeigt erstmalig stukturelle Einzelheiten des wichtigen C-Terminus eines Rab-Moleküls. Dieser so genannte hypervariable Bereich des Moleküls enthält einen Großteil der im Rab-Molekül vorhandenen Information über die Zielsteuerung (Targeting) des Moleküls und somit der Transportvesikel.
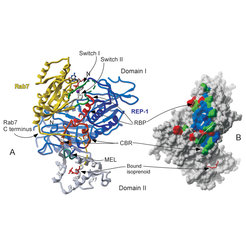
Die Struktur eines Komplexes zwischen einem prenylierten Rab-Molekül (Rab7) und REP-1 zeigte ähnliche Merkmale (Abb. 3). Auch in diesem Falle wird die Bindungsstelle für den Prenylrest durch Öffnung eines hydrophoben Tunnels erzeugt. Im Vergleich zum Ypt1:GDI- Komplex scheint der Rest weniger stark gebunden zu sein und die zirka 10 Aminosäuren des C-Terminus sind so schlecht geordnet, dass sie in der Elektronendichtekarte nicht sichtbar sind.
In beiden Strukturen (das heißt in den Ypt1:GDI- und Rab7:REP-1-Strukturen) zeigen die Wechselwirkungen zwischen den GTPase-Domänen der Rab-Moleküle mit ihren Partnermolekülen die Ursachen für zwei wichtige, verwandte Eigenschaften der REP/GDI-Familie. Der GDI-Effekt stammt von einer Stabilisierung der Struktur der so genannten Switch II-Region der Rab-Moleküle. Diese Stabilisierung beeinflusst Wassermoleküle, die am essentiellen Magnesiumion koordiniert sind. Dieses Metallion ist wiederum an der ß-Phosphatgruppe von GDP gebunden, sodass die Dissoziation des Nukleotids über diesen indirekten Mechanismus verlangsamt wird. Von größerer Bedeutung für die Wirkungsweise von REP und GDI ist deren vorrangige Bindung an die GDP-Formen der Rab- Proteine, da dies die Extraktion nur dieser Form und nicht der GTP-Form aus der Membran erlaubt. Ein Vergleich der Struktur von Rab7 im Rab7:REP-1-Komplex mit der Struktur von Rab7 ohne Proteinpartner, aber mit gebundenem GTP-Analog, zeigt, dass der Switch II-Bereich von Rab7 eine völlig unterschiedliche Struktur in beiden Zuständen annimmt, sodass die Wechselwirkungen sich gegenseitig ausschließen. Im Gegensatz dazu ist Switch II in Rab7:GDP ohne REP nicht geordnet, sodass die REP (und GDI) bindende Konformation bei Wechselwirkung mit den beiden Proteinen angenommen werden kann.
Mutationen oder Zerstörung der Proteine der REP/GDI-Familie sind ursächlich an verschiedenen Krankheiten beteiligt. So führt der Austausch von Leucin gegen Prolin an Position 91 des menschlichen GDI zu einer bestimmten Form familiärer geistiger Retardierung. Diese Mutation verringert die Fähigkeit von GDI, Rab-Moleküle aus der Membran zu extrahieren. Bisher wurde angenommen, dass dieser Effekt daher stammt, dass sich die mutierte Aminosäure in der Lipidbindungsstelle befindet. Anhand der Ypt1: GDI-Struktur ist es offensichtlich, dass diese Interpretation falsch ist. Leucin 91 befindet sich in der Bindungsstelle für den C-Terminus von Rab, aber noch relativ weit von der Lipidbindungsstelle entfernt. Durch diesen Austausch geht eine wichtige hydrophobe Wechselwirkung verloren, sodass die Affinität von GDI für Rab-Moleküle verringert wird. Bei einer weiteren Erbkrankheit, der Chorioideremie, ist das Gen für REP-1 defekt. Dies führt zu progressivem Zerfall der Retina und zur Blindheit im frühen Erwachsenenalter. Auf der molekularen Ebene scheint dieser Zerfall von einer Akkumulation nicht-prenylierter Rab27-Moleküle verursacht zu werden. Bisher wurde angenommen, dass dieser Rab-spezifische Effekt daher stammt, dass Rab27 nicht oder nur schlecht von REP-2 erkannt wird. Wir haben die Geranylgeranylierung von Rab27 in Anwesenheit von REP-2 untersucht und festgestellt, dass die Prenylierung um einen Faktor von zirka 2 langsamer als in Anwesenheit von REP-1 ist. Allerdings werden andere Rab- Moleküle auch um diesen Faktor langsamer prenyliert, sodass die bisher geltende Erklärung nicht zutreffen kann. Die Unterprenylierung scheint vielmehr daher zu stammen, dass Rab 27 generell sehr viel schlechter an REP (das heißt an REP-1 oder REP-2) gebunden wird, sodass es mit anderen, stärker-bindenden Rab-Molekülen (in unserenVersuchen Rab 7) schlecht konkurrieren kann. Dieser Effekt ist nicht weiter nachteilig, solange die Summe der Aktivität von REP-1 und REP-2 vorhanden ist, führt aber zu Problemen, wenn durch den Verlust von REP-1 die Gesamtaktivität von REP reduziert wird. Diese Erkenntnis kann von Bedeutung bei der Entwicklung von Therapieansätzen gegen Chorioideremie sein. Bisher war man davon ausgegangen, dass der gentherapeutische Ersatz der fehlenden REP-1-Aktivität der einzige rationale Ansatz wäre. Nach den Erkenntnissen der Arbeitsgruppe in Dortmund könnte auch eine Erhöhung der Expression von REP-2 ausreichen.


