Nebel um Nebulin gelichtet! Erstes hochaufgelöstes 3D-Bild eines Muskelproteins
Forschende des Max-Planck-Instituts in Dortmund bilden die Struktur des Muskelproteins Nebulin mit Hilfe der Kryo-Elektronentomographie ab
Forschende haben das erste hochaufgelöste 3D-Bild von Nebulin erhalten, einem riesigen aktinbindenden Protein, das ein wesentlicher Bestandteil der Skelettmuskulatur ist. Mit dieser Entdeckung kann die Funktion von Nebulin nun besser verstanden werden, welche aufgrund der Größe von Nebulin und der Schwierigkeit, es im natürlichen Zustand aus dem Muskel zu extrahieren, bisher weitgehend unbekannt war. Das Team unter der Leitung von Stefan Raunser, Direktor am Max-Planck-Institut für molekulare Physiologie in Dortmund, hat in Zusammenarbeit mit Mathias Gautel vom King's College London die Elektronen-Kryo-Tomographie eingesetzt, um die Struktur von Nebulin in beeindruckender Detailgenauigkeit zu entschlüsseln. Die Ergebnisse könnten zu neuen Therapieansätzen bei Muskelkrankheiten wie z.B. der Nemalin-Myopathie führen, da genetische Mutationen in Nebulin mit einem dramatischen Verlust der Muskelkraft einhergehen.
Ein schwer fassbares Protein
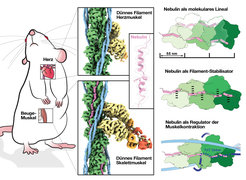
Skelett- und Herzmuskeln kontrahieren und entspannen sich durch das Zusammenwirken von parallelen Filamenten, die aus den Proteinen Myosin und Aktin aufgebaut sind. Nebulin, ein Protein, das nur in der Skelettmuskulatur vorkommt, verbindet sich mit Aktin, um es zu stabilisieren und regulieren. Mutationen in dem Nebulin-Gen können ein abnormales Protein hervorbringen, was eine Nemalin-Myopathie zur Folge hat. Dabei handelt es sich um eine unheilbare neuromuskuläre Störung mit verschiedenen Schweregraden, die von Muskelschwäche bis hin zu Sprach- und Atemproblemen reichen.
Die Kenntnis der 3D-Struktur von Nebulin und die Grundlage seiner Wechselwirkung mit Aktin könnte für die Entwicklung neuer Therapien von entscheidender Bedeutung sein. Herkömmliche experimentelle Ansätze, bei denen Nebulin im Reagenzglas nachgebaut wird, scheiterten jedoch an der Größe des Proteins, seiner Flexibilität und der Tatsache, dass es mit Aktin verflochten ist. Raunser und sein Team verfolgen einen anderen Ansatz: Sie machen Aktin und Nebulin direkt in ihrer natürlichen Umgebung, dem Muskel, sichtbar, indem sie eine leistungsstarke Mikroskopietechnik namens Kryo-Elektronentomographie (Kryo-ET) einsetzen. Ein Kryo-ET-Experiment beginnt mit dem Schnellgefrieren von Muskelproben. Mit einem Ionenstrahl wird dann Material von der Probe abgetragen bis eine ideale Dicke von etwa 100 Nanometern für das Transmissionselektronenmikroskop erreicht ist. Dieses leistungsstarke Instrument nimmt dann mehrere Bilder der Probe auf, während diese entlang einer Achse gekippt wird. Schließlich wird mit Hilfe von Berechnungsmethoden ein dreidimensionales Bild mit einer beeindruckend hohen Auflösung erstellt.
Die Grenzen der Kryo-ET ausreizen
In einer Veröffentlichung aus dem Jahr 2021 haben die Max-Planck-Forschenden das erste detaillierte 3D-Bild des Sarkomers erstellt, der kontraktilen Grundeinheit von Skelett- und Herzmuskelzellen, die Aktin, Myosin und schließlich das Nebulinprotein enthält. Die Auflösung von einem Nanometer (ein Millionstel Millimeter) war gut genug, um Aktin und Myosin abzubilden, aber zu gering, um Nebulin sichtbar zu machen. Dieses Mal verbesserte das Team die Datenerfassung und -verarbeitung, um ein 3D-Bild der Skelettmuskelfilamente mit nahezu atomarer Auflösung (0,45 Nanometer) zu erhalten. Durch den Vergleich der Bilder des Skelettmuskels mit dem nebulinfreien Herzmuskel wurde die Struktur des langen Nebulinproteins deutlich, und die Forschenden konnten ein atomares Modell des Nebulins erstellen. "Dies ist die erste hochaufgelöste Struktur, bei der FIB-Fräsen und Kryo-ET zum Einsatz kommen. Damit ist bewiesen, dass wir mit dieser Methode auf zuverlässige Weise atomare Modelle erstellen können. Das ist ein Quantensprung!", sagt Raunser.
Die Ergebnisse zeigen, dass jede Nebulin-Wiederholung an eine Aktin-Untereinheit bindet. Dadurch wirkt Nebulin wie ein Lineal und bestimmt die Länge des Aktinfilaments. Außerdem interagiert jede Nebulin-Wiederholung mit allen benachbarten Aktin-Untereinheiten, was seine Rolle als Stabilisator des Filaments erklärt. Schließlich schlagen die Forschenden vor, dass Nebulin die Bindung von Aktin und Myosin und damit die Muskelkontraktion durch Wechselwirkung mit einem anderen Protein, namens Troponin, reguliert. Die Experimente wurden an Mausmuskeln durchgeführt, die den menschlichen Muskeln sehr ähnlich sind - und am King's College London isoliert wurden.
"Wir haben eine detaillierte in situ 3D-Struktur von Nebulin, Aktin und Myosinköpfen erhalten, die dazu verwendet werden kann, die Mutationen, die zu Myopathien führen, exakt zu lokalisieren", erklärt Raunser. „Arzneimittelforschende können diese neue Struktur nutzen, um Bindungsstellen für kleine Moleküle von pharmazeutischem Interesse zu finden“, fügt er hinzu. Angetrieben von ihrem jüngsten Erfolg wird sich die Gruppe nun darauf konzentrieren, die strukturellen Details von Myosin, dem anderen Gleitfilament, zu entschlüsseln. Diese Erkenntnisse werden das vorhandene Wissen der Skelettmuskelkontraktion auf molekularer Ebene komplettieren.


