Snooker in der lebenden Zelle
Neue Technik zur Aktivitätskontrolle von zellulären Prozessen
Die räumliche und zeitliche Dynamik von Proteinen oder Organellen in der lebenden Zelle spielen eine entscheidende Rolle bei der Steuerung verschiedener zellulärer Prozesse und bei der Entstehung von Krankheiten. Eine simultane, direkte Manipulation der zellulären Aktivität an verschiedenen Stellen innerhalb einer Zelle war bisher nicht möglich. Jetzt präsentieren Wissenschaftler der Universität Umeå (Schweden) und des Max-Planck-Instituts für Molekulare Physiologie in Dortmund (Deutschland) in der neuesten Ausgabe der Zeitschrift Angewandte Chemie eine neue chemo-optogenetische Methode, die eine feine, reversible und schnelle Steuerung der Aktivität in mehrerer zellulärer Bereichen einer lebenden Zelle ermöglicht.
Die räumliche und zeitliche Dynamik von Proteinen oder Organellen in der lebenden Zelle spielen eine entscheidende Rolle bei der Steuerung verschiedener zellulärer Prozesse und bei der Entstehung von Krankheiten. Eine simultane, direkte Manipulation der zellulären Aktivität an verschiedenen Stellen innerhalb einer Zelle war bisher nicht möglich. Jetzt präsentieren Wissenschaftler der Universität Umeå (Schweden) und des Max-Planck-Instituts für Molekulare Physiologie in Dortmund (Deutschland) in der neuesten Ausgabe der Zeitschrift Angewandte Chemie eine neue chemo-optogenetische Methode, die eine feine, reversible und schnelle Steuerung der Aktivität in mehrerer zellulärer Bereichen einer lebenden Zelle ermöglicht.
Zellen benötigen für ihre Reaktionen auf Umweltveränderungen ein ausgewogenes System von Signalwegen. Proteine auf der Zelloberfläche, in der Zellmembran und im Zellinnern orchestrieren viele fein abgestimmte Reaktionsketten, die zu einer koordinierten Reaktionen auf die Umweltbedingungen oder Veränderungen im Organismus selbst führen. Auch die räumlich-zeitliche Organisation von zellulären Prozessen, zum Beispiel zelluläre Signalwege, Zellpolarisierung und das Wachstum von Nervenfasern, wird oft durch die Verteilung von Molekülen oder Organellen reguliert.
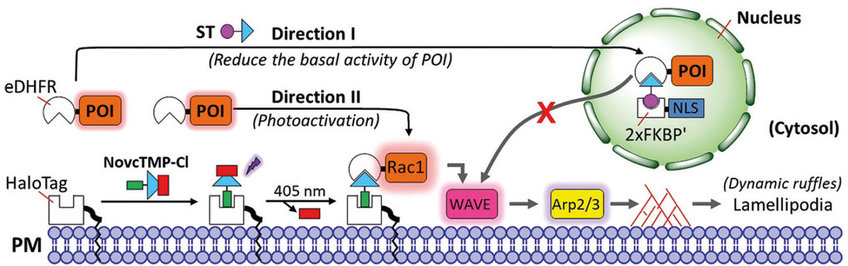
Dabei können Proteine je nach Aufenthaltsort in der Zelle verschiedene Funktionen erfüllen. Ein Beispiel ist das Rac1-Protein. An der Plasmamembran lokalisiert, kontrolliert es die Form des Zytoskeletts. Im Zellkern hingegen reguliert es die Struktur des Zellkernes. Das Pendeln von Rac1 zwischen Zellmembran und Zellkern spielt eine wichtige Rolle bei der Ausbreitung von Tumoren im Gewebe. In Nervenzellen ist der bidirektionale Transport entlang Mikrotubuli essentiell für die korrekte Verteilung von Organellen. Fehler bei diesem Prozess spielen eine wesentliche Rolle bei der Entwicklung neurodegenerativer Erkrankungen. Eine detaillierte, experimentelle Analyse der räumlichen und zeitlichen Organisation der Signalmoleküle und Organellen innerhalb der Zeller war bisher eine große Herausforderung in der Grundlagenforschung.
Das Forschungsgruppen von Yaowen Wu und Leif Dehmelt, der erst kürzlich zum Professor an das Chemische Institut der Universität Umeå berufen wurde, hat jetzt eine neue Methode zur räumlichen Live-Studie von Zellsignalen entwickelt. Mit der sogenannten "Multidirektionale Aktivitätskontrolle (MAC)". können Zellsignale simultan in unterschiedlichen Zellbereichen gestört werden. Damit leisteten die Wissenschaftler wichtige Pionierarbeit in der Entwicklung von Methoden, die die Beobachtung von zellulären Mechanismen in Realzeit und unter kontrollierten Bedingungen möglich machen.
In der vorliegenden Studie verwendete das Forscherteam ein chemisches System um die Position von Organellen und Proteinen an mehreren Stellen in einer einzelnen Zelle zu steuern. Das von den Chemikern entwickelte sogenannte pdCID-System kombiniert zwei chemische Reaktionen, um ein Dimer eines bakteriellen Proteinen zu bilden. Eine Reaktion konnte dabei mit Lichtsignalen kontrolliert werden. PdCID steht für photoactivatable, dual-chemically induced dimerization.
„Wir konnten zeigen dass unser durch Licht- und chemisches Signal ausgelöstes Dimerisierungs-System genutzt werden kann, um in einer einzelnen Zelle unterschiedliche Funktionen von zellulären Organellen und Signalwegen auf mehreren aufeinander fein abgestimmten Ebenen zu kontrollieren. Dies war mit anderen Methoden bisher nicht möglich gewesen. Wir haben also zwei modulare Systeme parallel oder kompetitiv miteinander kombiniert. Dadurch konnten wir die Aktivität der Proteine oder Organellen sowohl durch chemische Moleküle als auch durch Licht regulieren und studieren“, erklärt Yaowen Wu, der gerade sein neues Labor in Nordschweden aufbaut.
Die Forschergruppe konnte auch zeigen, dass ihre neue Technologie eine sehr schnelle simultane Anregung und Beobachtung verschiedener zellulärer Reaktionen ermöglicht. Dies ermöglicht erstmals Studien zu Störungen in zellulären Signalwegen, die mit traditionellen genetischen Forschungsansätzen nicht möglich sind.
Konkret konnten die Teams um Yaowen Wu und Leif Dehmelt gleich mehrere Transportwege von Rac1 zwischen dem Zytosol (Zellinnern), der Plasmamembran und dem Kern in einer einzigen Zelle simultan studieren. Auch konnte der Transport von Peroxisomen (einer Zellorganelle, die an der Oxidation von Molekülen beteiligt ist) in zwei Richtungen gesteuert werden, d. h. zur Zelloberfläche hin und umgekehrt zurück in das Innere der Zelle, ähnlich wie bei einem Snooker-Spiel im Mikrometer-Bereich.
„Der MAC-Ansatz könnte letztlich auch genutzt werden, um krankhafte Zustände in der Zelle zu unterdrücken oder zu blockieren, um Krankheiten zu studieren und damit therapeutische Methoden zu unterstützen“, schreibt die Gruppe in ihrer für die Forschung sehr wichtigen Veröffentlichung in der renommierten Zeitschrift Angewandte Chemie.
EMD/YW/JJ