Cryo-EM structure of the ClpXP protein degradation machinery
Raisch T, Chang CT, Levdansky Y, Muthukumar S, Gatsogiannis C, Balogh D, Merino F, Sieber S, Raunser S (2019). Nat. Struct. Mol. Biol.
doi: 10.1038/s41594-019-0304-0.
Antibiotics are still the most important weapon to fight bacterial infections. However, medicine is running out of ammunition due to increasing resistance. One approach to the development of innovative antibiotics aims at the degradation process of defective proteins in bacteria.
The group of Prof. Dr. Stephan Sieber (Technical University of Munich) together with the group of Prof. Dr. Stefan Raunser, Director at the Max Planck Institute (MPI) of Molecular Physiology in Dortmund, have now unveiled the first high-resolution 3D structure of the protein degrading complex ClpX-ClpP and thus created an important structural basis for future pharmacological applications.
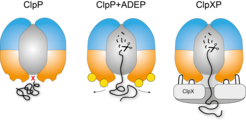
Mechanismus der Regulation von ClpP durch ClpX und ADEP. Links: Die Abbaukammer von ClpP ist verschlossen. Mitte: Bindet ADEP an ClpP, öffnet sich die Abbaukammer und löst den unkontrollierten Abbau von Proteinen aus. Rechts: Eine Bindung von ClpX an ClpP löst keine Öffnung der Protease aus. Die durch ClpX katalysierte Entfaltung der Zielproteine ermöglicht den Eintritt in die Abbaukammer.
MPI Dortmiund
