Erste 3D-Struktur von Regulator-Protein aufgedeckt
Forschende schaffen molekulare Grundlagen für ein besseres Verständnis der Regulation von zellulären Abbauprozessen
Forschende um die Professoren Dr. Daniel Kümmel von der Westfälischen Wilhelms-Universität (WWU) Münster und Dr. Stefan Raunser vom Max-Planck-Institut für molekulare Physiologie (MPI) in Dortmund haben die Struktur eines Proteinkomplexes aufgeklärt, der ein wichtiger Regulator von zellulären Abbauprozessen ist. Die Struktur von Mon1/Ccz1 hat eine einzigartige Architektur und könnte als Blaupause für ein besseres Verständnis verwandter Regulatorproteine dienen.
Proteine sind unverzichtbare Bestandteile lebender Organismen. Sie sind nicht nur eine „Bausubstanz“ für den Körper, sondern ermöglichen beispielsweise die molekulare Kommunikation der Zellen, sind für das Entstehen von Nervenimpulsen nötig und kontrollieren chemische Reaktionen. Entscheidend für die Funktion der Proteine ist ihre dreidimensionale Struktur. Ist diese bekannt, können Rückschlüsse auf die Funktionsweise von Proteinen gezogen werden. Ein Team um Daniel Kümmel von der WWU Münster und Stefan Raunser vom MPI in Dortmund hat nun die Struktur des Proteinkomplexes Mon1/Ccz1 aufgeklärt, der ein wichtiger Regulator von zellulären Abbauprozessen ist.
Mon1/Ccz1 bestimmt, welche intrazellulären Vesikel ihren Inhalt an den zellulären „Recyclinghof“, das Lysosom, liefern. Dazu dockt er an die Vesikelmembran an und ergänzt dort eine Markierung. Intrazelluläre Vesikel sind Membranbläschen, die Material durch die Zelle transportieren. Im Lysosom wird ihr Inhalt abgebaut und wiederverwertet. Durch die Aufklärung der Struktur in nahezu atomarer Auflösung konnten die Forschenden nun unter anderem klären, wie der Proteinkomplex die passenden Vesikel erkennt. So konnten sie z.B. zeigen, dass der Komplex einen positiv geladenen, relativ flachen Bereich hat, der seine Orientierung nach dem Andocken an die Vesikelmembran bestimmt.
„Mon1/Ccz1“ gehört zu einer Familie von Regulatoren, für die bisher keine strukturellen Informationen vorliegen. Diese Komplexe sind in vielfältige zelluläre Vorgänge eingebunden und teilweise auch mit dem Auftreten von Entwicklungsstörungen wie Albinismus und Blutgerinnungsdefekten assoziiert“, unterstreicht Daniel Kümmel. „Unsere Struktur liefert nun eine Grundlage, um diese Zusammenhänge besser zu verstehen“.
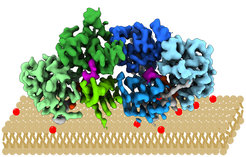
Der untersuchte Proteinkomplex stammt aus dem Fadenpilz Chaetomium thermophilum und ist unter Laborbedingungen besonders leicht zu handhaben und stabil. Er kann als Modell für die humanen Proteine dienen. Zur Bestimmung der Proteinstruktur setzten die Forschenden hochauflösende Kryoelektronenmikroskopie ein. „Mit dieser Methode können wir die Struktur von Proteinen bei Temperaturen um -150 °C im nahezu natürlichen Zustand untersuchen“, sagt Stefan Raunser.. Die Forschenden überprüften ihre Ergebnisse durch biochemische Untersuchungen, beispielsweise Sedimentationsessays. Dabei wird die Protein-Membran-Interaktion mit künstlichen Vesikeln und gereinigtem Protein in vitro, also außerhalb des Organismus, nachgewiesen. „Die Struktur von Mon1/Ccz1 hat eine einzigartige Architektur, die nach unserem aktuellen Wissensstand noch in keinem anderen Proteinkomplex nachgewiesen worden ist. Sie könnte als Blaupause für ein besseres Verständnis andere verwandter Regulatorproteine dienen. Wir wollen unsere erfolgreiche Zusammenarbeit in diesem Bereich fortsetzen und neue Einblicke in die Regulation von Abbauprozessen gewinnen.“, sind sich Daniel Kümmel und Stefan Raunser einig.
Weitere Informationen und Finanzierung:
Die Studie wurde im interdisziplinären Fachjournal „Proceedings of the National Academy of Sciences of the United States of America“ veröffentlicht. Neben Forschenden der WWU Münster und vom MPI Dortmund waren Forschende der Universität Osnabrück beteiligt.
Die Deutsche Forschungsgemeinschaft unterstützte die Arbeiten im Rahmen des Sonderforschungsbereichs (SFB) 944 finanziell.
