Molekulare Spritze ebnet den Weg für neue Therapieansätze
Der Angriffsmechanismus, mit dem bestimmte pathogene Bakterien tödliche Enzyme in ihre Wirte injizieren
Von der Nobelpreis-gekrönten Genschere CRISPR bis hin zu COVID-19-mRNA-Impfstoffen – die Kontrolle über Biomoleküle hat sich als einer der bedeutendsten Fortschritte in der Wissenschaft und Medizin im letzten Jahrzehnt herausgestellt. Nur mit genauen Kenntnissen der zugrunde liegenden molekularen Mechanismen können diese Prozesse auf kontrollierte Weise nachgeahmt und somit nutzbar gemacht werden. In einer gemeinsamen Anstrengung hat ein internationales Team um Stefan Raunser, Direktor am Max-Planck-Institut für molekulare Physiologie in Dortmund, Enrica Bordignon, Universität Genf (UNIGE), und Claus Seidel, Heinrich-Heine-Universität Düsseldorf, nun wichtige Erkenntnisse über den Mechanismus gewonnen, mit dem bestimmte pathogene Bakterien tödliche Enzyme in ihre Wirte injizieren. Das detaillierte molekulare Verständnis der verschiedenen Schritte hinter diesem Prozess könnte potenzielle Anwendungen von Tc-Toxinen in der Biotechnologie und Medizin ermöglichen.
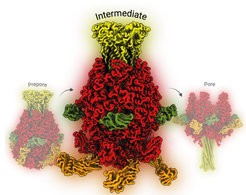
Tc-Toxine sind Proteinkomplexe, die von bestimmten Bakterien produziert werden und wie winzige Spritzen funktionieren. Sie heften sich an die Oberfläche einer Wirtszelle und injizieren unter geeigneten Bedingungen schädliche Enzyme in die Zelle. Die molekularen Mechanismen, die der Tc-Toxin-Freisetzung und -Vergiftung zugrunde liegen, einschließlich der Toxinaktivierung, Rezeptorbindung und Membranpermeation, wurden bereits von der Gruppe um Stefan Raunser, Direktor am Max-Planck-Institut in Dortmund, und anderen aufgeklärt. Detaillierte Einblicke in das eigentliche Injektionsverfahren sind jedoch nach wie vor nur schwer zu gewinnen. Bisher beruhen sie ausschließlich auf der Beobachtung von Anfangs- und Endzuständen.
Die Wirkungsweise dieser molekularen Spritze besser zu verstehen, sie sogar nachzuahmen oder zu kontrollieren, würde die Entwicklung gezielter Therapien für bakterielle Infektionen, umweltfreundlicher Biopestizide und innovativer Arzneimittelabgabesysteme ermöglichen. Letztere zielen darauf ab, die Präzision und Wirksamkeit von Behandlungen zu verbessern, indem sichergestellt wird, dass Arzneimittel direkt an den Zielort im Körper, z. B. Krebszellen, abgegeben werden. So können auch Schäden an gesundem Gewebe minimiert werden. Die Entwicklung derart vielversprechender Strategien erfordert jedoch ein detailliertes Verständnis des natürlichen Infektionsprozesses durch solche Toxine.
In einer aktuellen Studie des Max-Planck-Instituts für molekulare Physiologie, der UNIGE und der Heinrich-Heine-Universität Düsseldorf haben Forschende den detaillierten Mechanismus der spritzenartigen Injektionsmechanismen von Tc-Toxinen entschlüsseln können. Dr. Svetlana Kucher, leitende Postdoktorandin in der Abteilung für physikalische Chemie an der naturwissenschaftlichen Fakultät der UNIGE und Erstautorin der Studie, erklärt: „Diese Kombination aus Kryo-Elektronenmikroskopie, Einzelmolekül-Fluoreszenzspektroskopie und Elektronenparamagnetische Resonanz (EPR)-Spektroskopie ermöglicht es uns, sowohl einzelne molekulare Strukturen in Echtzeit als auch die Massendynamik zu erfassen, wodurch wir ein beispielloses Bild des Infektionsmechanismus des Tc-Toxins erhalten.“
Enrica Bordignon, Professorin am Institut für Physikalische Chemie der UNIGE und Prodekanin der naturwissenschaftlichen Fakultät, kommentiert: „Es war eine spannende gemeinsame Reise, die uns zu dem Schluss brachte, dass der intuitive Spritzenmechanismus für die Toxininjektion tatsächlich viel komplexer ist und einen mehrstufigen Weg umfasst. Der hier angewandte interdisziplinäre Ansatz war der Schlüssel zum Ergebnis.“
Stefan Raunser, geschäftsführender Direktor des Max-Planck-Instituts für molekulare Physiologie, erklärt: „Diese äußerst präzisen Mechanismen mögen einfach klingen, da wir Spritzen leicht herstellen und verwenden können, um Materialien im menschlichen Maßstab zu injizieren. Die Beobachtung und Beschreibung dieser Art von Mechanismen auf molekularer Ebene ist jedoch eine enorme Herausforderung. Die genaue Abfolge zu kennen, wird dazu beitragen, neue Biotechnologien wie molekulare Spritzen für medizinische Anwendungen zu entwickeln.“